- Химические свойства
- Физические свойства
- Строение углерода
- Строение атома
- Роль в природе
- Реакции графита.
- Неорганические соединения углерода
- Место в таблице Менделеева
- Качественные реакции
- Карбонилы.
- История открытия
- Галогениды углерода.
- Аллотропия углерода
- Азотпроизводные углерода.
- Цианиды
- Угольная кислота и её соли
- Уголь
- Сравнение основных аллотропных модификаций углерода
- Оксид углерода (IV) СO 2
- Оксид углерода (II) СО
- Карбонаты
- Карбин
- Карбиды
- Графит
- Графен
- Алмаз
Химические свойства
В обычных условиях углерод, как правило, химически инертен, но при высоких температурах он может вступать в химические взаимодействия со многими другими элементами, обычно проявляя сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C0 + O2 –t°= 2C+2O угарный газ
— со фтором
С + 2F2 = CF4
— с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом, выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Порой углерод может выступать и как окислитель, образуя карбиды при вступлении в химические реакции с некоторыми металлами:
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
Вступая в реакцию с водородом, углерод образует метан:
C0 + 2H2 = CH4
Физические свойства
Своими физическими свойствами углерод типичный неметалл. При этом он образует множество аллотропных модификаций («аллотропные» означает существование двух и более разных веществ из одного химического элемента): наиболее популярными из них являются алмаз, графит, уголь, сажа. При этом алмаз – одно из самых твердых веществ, представляющих углерод.
Разумеется, разные аллотропные модификации углерода имеют и разные физические свойства. Если алмаз типичное твердое тело, то, к примеру, жидкий углерод, который можно получить только при определенном внешнем давлении, обладает совершенно иными физическими свойствами, нежели алмаз или графит.
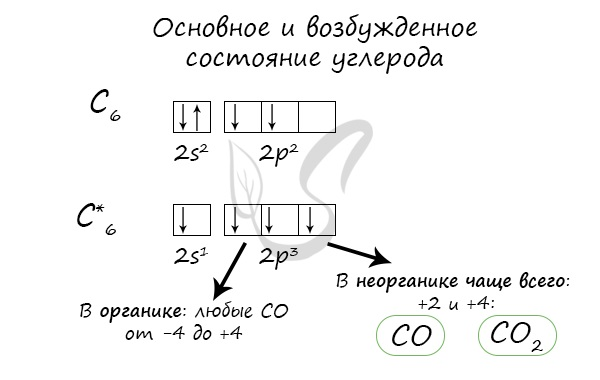
Строение углерода
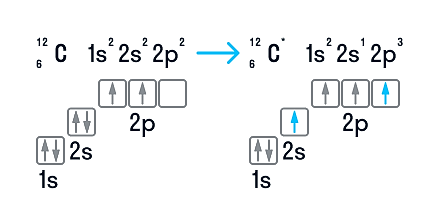
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен. Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Строение атома
Атом углерода имеет 2 оболочки (как впрочем, и все элементы, расположенные во втором периоде) и 6 электронов: 1s22s22p2. Четыре валентных электрона находятся на внешнем электронном уровне атома углерода. А оставшиеся два электрона находятся на отдельных p-орбиталях, при этом они являются неспаренными.
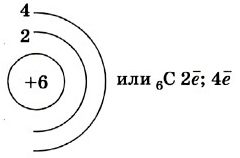
Так на картинке изображена схема электронного строения атома углерода.
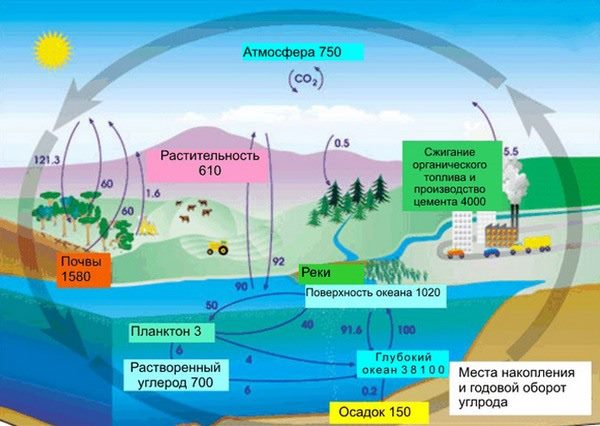
Роль в природе
В земной коре содержание углерода составляет всего лишь 0,15%. Несмотря на эту кажущуюся маленькой цифру, стоит заметить, что углерод непрерывно участвует в природном круговороте из земной коры через биосферу в атмосферу и наоборот. Также именно из углерода состоят такие ценные ресурсы как нефть, уголь, торф, известняки и природный газ. И как мы писали в начале нашей статьи, углерод – основа жизни. Скажем, в теле взрослого человека с весом в 70 кг имеется около 13 кг углерода. Это только в одном человека, примерно в таких же пропорциях углерод содержится в телах всех других живых существ, растений и животных.
Реакции графита.
Графит как модификация углерода, отличающаяся большими расстояниями между слоями гексагональных колец, вступает в необычные реакции, например, щелочные металлы, галогены и некоторые соли (FeCl3) проникают между слоями, образуя соединения типа KC8, KC16 (называемые соединениями внедрения, включения или клатратами). Сильные окислители типа KClO3 в кислой среде (серной или азотной кислоты) образуют вещества с большим объемом кристаллической решетки (до 6 Å между слоями), что объясняется внедрением кислородных атомов и образованием соединений, на поверхности которых в результате окисления образуются карбоксильные группы (–СООН) – соединения типа оксидированного графита или меллитовой (бензолгексакарбоновой) кислоты С6(COOH)6. В этих соединениях отношение С:O может изменяться от 6:1 до 6:2,5.
Неорганические соединения углерода
Ни ионы С 4+ , ни С 4- ‑ ни при каких обычных химических процессах не образуются: в соединениях углерода имеются ковалентные связи различной полярности.
Место в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. Атомная масса углерода составляет 12,011, согласно ней он занимает почетное 6-е место в таблице Менделеева и обозначается латинской литерой С.
Помимо этого следует обратить внимание на следующие характеристики углерода:
- Природный углерод состоит из смеси двух стабильных изотопов 12С (98,892%) и 13С (1,108%)
- Помимо этого известно 6 радиоактивных изотопов углерода. Один из них, изотоп 14С с периодом полураспада 5,73*103 лет в небольших количествах образуется в верхних слоях атмосферы нашей планеты под действием космического излучения.
Качественные реакции
Качественная реакция на карбонат-ионы CO32- — взаимодействие солей-карбонатов с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение – углекислый газ.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видеоопытвзаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
CO2 + Ca(OH)2 → CaCO3 + H2O
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2

Видеоопытвзаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО2не поддерживает горение. Угарный газ CO горит голубым пламенем.

Карбонилы.
Монооксид углерода способен непосредственно реагировать со многими металлами или ионами металлов, образуя комплексные соединения, называемые карбонилами, например Ni(CO)4, Fe(CO)5, Fe2(CO)9, [Fe(CO)4]3, Mo(CO)6, [Co(CO)4]2. Связь в этих соединениях аналогична связи в описанных выше цианокомплексах. Ni(CO)4 – летучее вещество, используется для отделения никеля от других металлов. Ухудшение структуры чугуна и стали в конструкциях часто связано с образованием карбонилов. Водород может входить в состав карбонилов, образуя карбонилгидриды, такие, как H2Fe(CO)4 и HCo(CO)4, проявляющие кислотные свойства и реагирующие со щелочью:
H2Fe(CO)4 + NaOH → NaHFe(CO)4 + H2O
Известны также карбонилгалогениды, например Fe(CO)X2, Fe(CO)2X2, Co(CO)I2, Pt(CO)Cl2, где Х – любой галоген МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ)см. также (.
История открытия
На самом деле углерод был известен человеку еще с глубокой древности в виде своих аллотропных модификаций: алмаза и графита. Помимо этого углерод в виде древесного угля активно применялся при выплавке металлов. От угля происходит и само название углерода, как химического элемента.
Но в те далекие времена люди пользовались углеродом в виде угля, или любовались им же, в виде алмазов, неосознанно, без понимания того, какой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Для получения углерода он пропускал пары фосфора над прокаленным мелом. В результате этой химической реакции образовались фосфат кальция и чистый углерод. Впрочем, этому опыту предшествовали и другие искания, например выдающийся французский химик Лавуазье поставил опыт по сжиганию алмаза при помощи большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой ничто иное как кристаллический углерод.

Интересно, что в этих опытах совместно с алмазом пробовали сжигать и другие драгоценные камни, к примеру, рубин. Но другие камни выдерживали высокую температуру, только алмаз сгорал без остатка, что и обратило внимание на его отличную химическую природу.
Галогениды углерода.
Углерод непосредственно реагирует с галогенами при нагревании, образуя тетрагалогениды, но скорость реакции и выход продукта невелики. Поэтому галогениды углерода получают другими методами, например, хлорированием дисульфида углерода получают CCl4:
CS2 + 2Cl2 ® CCl4 + 2S
Тетрахлорид CCl4 – негорючее вещество, используется в качестве растворителя в процессах сухой чистки, но не рекомендуется применять его как пламегаситель, так как при высокой температуре происходит образование ядовитого фосгена (газообразное отравляющее вещество). Сам ССl4 также ядовит и при вдыхании в заметных количествах может вызвать отравление печени. СCl4 образуется и по фотохимической реакции между метаном СH4 и Сl2; при этом возможно образование продуктов неполного хлорирования метана – CHCl3, CH2Cl2 и CH3Cl. Аналогично протекают реакции и с другими галогенами.
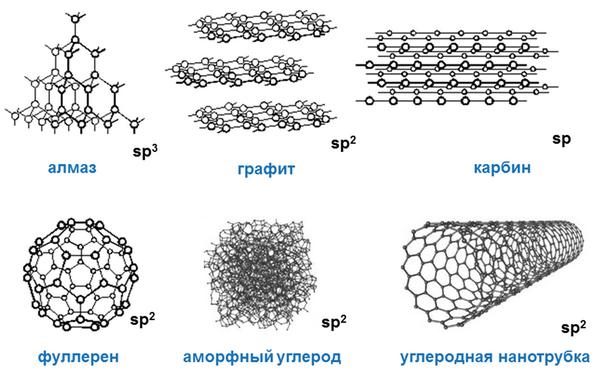
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
- Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
- Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Азотпроизводные углерода.
К этой группе относится мочевина NH2CONH2 – азотное удобрение, применяемое в виде раствора. Мочевину получают из NH3 и CO2 при нагревании под давлением:
Дициан (CN)2 по многим свойствам подобен галогенам и его часто называют псевдогалоген. Дициан получают мягким окислением цианид-иона кислородом, пероксидом водорода или ионом Cu2+: 2CN– ® (CN)2 + 2e.
Цианид-ион, являясь донором электронов, легко образует комплексные соединения с ионами переходных металлов. Подобно СО, цианид-ион является ядом, связывая жизненно важные соединения железа в живом организме. Цианидные комплексные ионы имеют общую формулу [M(CN)x]–0,5x, где х – координационное число металла (комплексообразователя), эмпирически равно удвоенному значению степени окисления иона металла. Примерами таких комплексных ионов являются (строение некоторых ионов приведено ниже) тетрацианоникелат(II)-ион [Ni(CN)4]2–, гексацианоферрат(III) [Fe(CN)6]3–, дицианоаргентат [Ag(CN)2]–:
Цианиды
получают при нагревании соды в атмосфере аммиака и угарного газа:
Na 2 CO 3 + 2 NH 3 + 3 CO = 2 NaCN + 2 H 2 O + H 2 + 2 CO 2
Синильная кислота HCN – важный продукт химической промышленности, широко применяется в органическом синтезе. Ее мировое производство достигает 200 тыс. т в год. Электронное строение цианид-аниона аналогично оксиду углерода (II), такие частицы называют изоэлектронными:
C = O: [:C = N:] –
Цианиды (0,1-0,2%-ный водный раствор) применяют при добыче золота:
2 Au + 4 KCN + H 2 O + 0,5 O 2 = 2 K[Au(CN) 2 ] + 2 KOH.
При кипячении растворов цианидов с серой или сплавлении твердых веществ образуются роданиды :
KCN + S = KSCN.
При нагревании цианидов малоактивных металлов получается дициан: Hg(CN) 2 = Hg + (CN) 2 . Растворы цианидов окисляются до цианатов :
2 KCN + O 2 = 2 KOCN.
Циановая кислота существует в двух формах:
H-N=C=O; H-O-C = N:
В 1828 г. Фридрих Вёлер (1800-1882) получил из цианата аммония мочевину: NH 4 OCN = CO(NH 2 ) 2 при упаривании водного раствора.
Это событие обычно рассматривается как победа синтетической химии над «виталистической теорией».
Существует изомер циановой кислоты – гремучая кислота
H-O-N=C.
Ее соли (гремучая ртуть Hg(ONC) 2 ) используются в ударных воспламенителях.
Синтез мочевины (карбамида):
CO 2 + 2 NH 3 = CO(NH 2 ) 2 + H 2 O. При 130 0 С и 100 атм.
Мочевина является амидом угольной кислоты, существует и ее «азотный аналог» – гуанидин.
Угольная кислота и её соли
H 2 CO 3 — Кислота слабая, существует только в водном растворе:
CO 2 + H 2 O ↔ H 2 CO 3
Двухосновная:
H 2 CO 3 ↔ H + + HCO 3 — Кислые соли — бикарбонаты, гидрокарбонаты
HCO 3 — ↔ H + + CO 3 2- Средние соли — карбонаты
Характерны все свойства кислот.
Карбонаты и гидрокарбонаты могут превращаться друг в друга:
2NaHCO 3 – t° = Na 2 CO 3 + H 2 O + CO 2
Na 2 CO 3 + H 2 O + CO 2 = 2NaHCO 3
Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
CuCO 3 – t° = CuO + CO 2
Качественная реакция — «вскипание» при действии сильной кислоты:
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
CO 3 2- + 2H + = H 2 O + CO 2
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
- Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
- Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
- Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
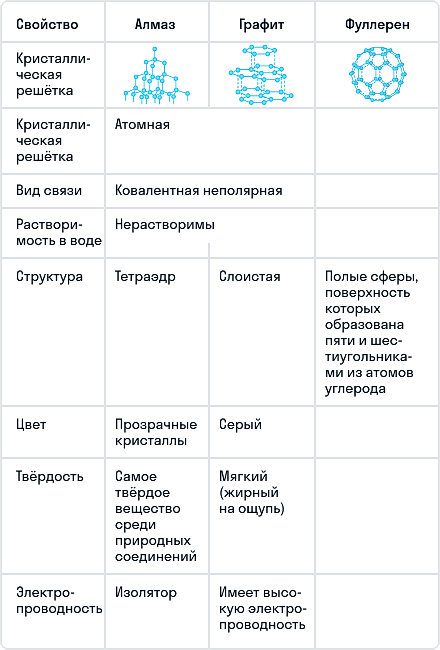
Сравнение основных аллотропных модификаций углерода
Оксид углерода (IV) СO 2
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H 2 O растворяется 0,9V CO 2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO 2 называется «сухой лёд»); не поддерживает горение.
Получение
- Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO 3 – t° = CaO + CO 2
- Действием сильных кислот на карбонаты и гидрокарбонаты:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2
NaHCO 3 + HCl = NaCl + H 2 O + CO 2
Химические свойства СO 2
Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Na 2 O + CO 2 = Na 2 CO 3
2NaOH + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 = NaHCO 3
При повышенной температуре может проявлять окислительные свойства
С +4 O 2 + 2Mg – t° = 2Mg +2 O + C 0
Качественная реакция
Помутнение известковой воды:
Ca(OH) 2 + CO 2 = CaCO 3 ¯(белый осадок) + H 2 O
Оно исчезает при длительном пропускании CO 2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO 3 + H 2 O + CO 2 = Сa(HCO 3 ) 2
Оксид углерода (II) СО
Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, t°кип = -192°C; t пл. = -205°C.
Получение
1) В промышленности (в газогенераторах):
C + O 2 = CO 2
CO 2 + C = 2CO
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H 2 SO 4 (конц.):
HCOOH = H 2 O + CO
H 2 C 2 O 4 = CO + CO 2 + H 2 O
Химические свойства
При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид.
1) с кислородом
2C +2 O + O 2 = 2C +4 O 2
2) с оксидами металлов
C +2 O + CuO = Сu + C +4 O 2
3) с хлором (на свету)
CO + Cl 2 – hn = COCl 2 (фосген)
4) реагирует с расплавами щелочей (под давлением)
CO + NaOH = HCOONa (формиат натрия)
5) с переходными металлами образует карбонилы
Ni + 4CO – t° = Ni(CO) 4
Fe + 5CO – t° = Fe(CO) 5
Карбонаты
Важнейшие неорганические соединения углерода – соли угольной кислоты (карбонаты). H 2 CO 3 – слабая кислота (К 1 =1,3·10 -4 ; К 2 =5·10 -11 ). Карбонатный буфер поддерживает углекислотное равновесие в атмосфере. Мировой океан обладает огромной буферной емкостью, потому что он является открытой системой. Основная буферная реакция – равновесие при диссоциации угольной кислоты:
H 2 CO 3 ↔ H + + HCO 3 — .
При понижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты:
CO 2 + H 2 O ↔ H 2 CO 3 .
При повышении кислотности происходит растворение карбонатных пород (раковины, меловые и известняковые отложения в океане); этим компенсируется убыль гидрокарбонатных ионов:
H + + CO 3 2- ↔ HCO 3 —
CaCO 3 (тв.) ↔ Ca 2+ + CO 3 2-
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс химического растворения избыточного углекислого газа противодействует «парниковому эффекту» – глобальному потеплению из-за поглощения углекислым газом теплового излучения Земли. Примерно треть мирового производства соды (карбонат натрия Na 2 CO 3 ) используется в производстве стекла.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Карбиды
Карбид кальция:
CaO + 3 C = CaC 2 + CO
CaC 2 + 2 H 2 O = Ca(OH) 2 + C 2 H 2 .
Ацетилен выделяется при реакции с водой карбидов цинка, кадмия, лантана и церия:
2 LaC 2 + 6 H 2 O = 2La(OH) 3 + 2 C 2 H 2 + H 2 .
Be 2 C и Al 4 C 3 разлагаются водой с образованием метана:
Al 4 C 3 + 12 H 2 O = 4 Al(OH) 3 = 3 CH 4 .
В технике применяют карбиды титана TiC, вольфрама W 2 C (твердые сплавы), кремния SiC (карборунд – в качестве абразива и материала для нагревателей).
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.