История возникновения
вполне возможно, что арабские алхимики производили азотную кислоту еще до средневековья. производство царской водки из азотной кислоты и хлорида аммония предположительно практиковалось арабскими алхимиками в 7 или 8 веке.
в 9-м веке арабский алхимик гебер добывал азотную кислоту путем сухого нагрева селитры.
в 13 веке альбертус магнус использовал азотную кислоту в качестве «разделительной воды» для производства золота.

производство серной кислоты и нитрата калия, которое до сих пор широко используется в лабораторных условиях, восходит к иоганну рудольфу глауберу (1604-1670). он произвел чистый нитрит, перегоняя селитру с серной кислотой .
глаубер был также первым, кто разработал процесс приготовления царской водки.
Описание и свойства
азотная кислота (hno3) является сильной кислотой с едкими, растворяющими и окисляющими свойствами.
азотная кислота 70% представляет собой прозрачную или почти бесцветную жидкость с резким запахом.
концентрированная азотная кислота легко разлагается (особенно под действием света и тепла) и часто имеет желтоватый или красноватый оттенок из-за растворенного в ней диоксида азота (no2).
чистая азотная кислота, содержащая свободный диоксид азота, называется дымящей азотной кислотой. она обладает сильным окислительным эффектом и может способствовать возгоранию некоторых легковоспламеняющихся веществ. например, соломы или древесных опилок.
100% красная (дымящая) азотная кислота в чистом виде бесцветна, если ее хранить в холодильнике, исключая попадание воздуха. при контакте с воздухом дымящаяся азотная кислота быстро разлагается с образованием сильно токсичного диоксида азота.
азотная кислота, которая окрашена в желтый цвет растворенным диоксидом азота, может быть обесцвечена небольшим количеством мочевины или нитрата мочевины.
соли азотной кислоты называются нитратами (селитра). на рынке в основном представлены соли калия и натрия — нитрат калия и нитрат натрия.
азотная кислота выпускается производителями в различных концентрациях:
- дымящая азотная кислота (чистая, холодная) — от 85% до 100%
- концентрированная азотная кислота: среднее — 69% (от 68% до 70%)
- азотная кислота (обычная, возможно без указания процентного содержания) — 65%
- разбавленная азотная кислота — 25%
Растворение металлов
азотная кислота растворяет большинство металлов. исключение составляют только драгоценные металлы: золото, платина и иридий.
некоторые металлы (алюминий, титан, цирконий, гафний, ниобий, тантал и вольфрам) сопротивляются действию азотной кислоты, образуя непроницаемый оксидный слой на металле.
поскольку таким образом можно было разделить золото и серебро, азотную кислоту раньше называли «разделительной водой».
при смешивании с соляной кислотой образуется так называемая «царская водка», которая способна растворить любые драгоценные металлы.
Структура
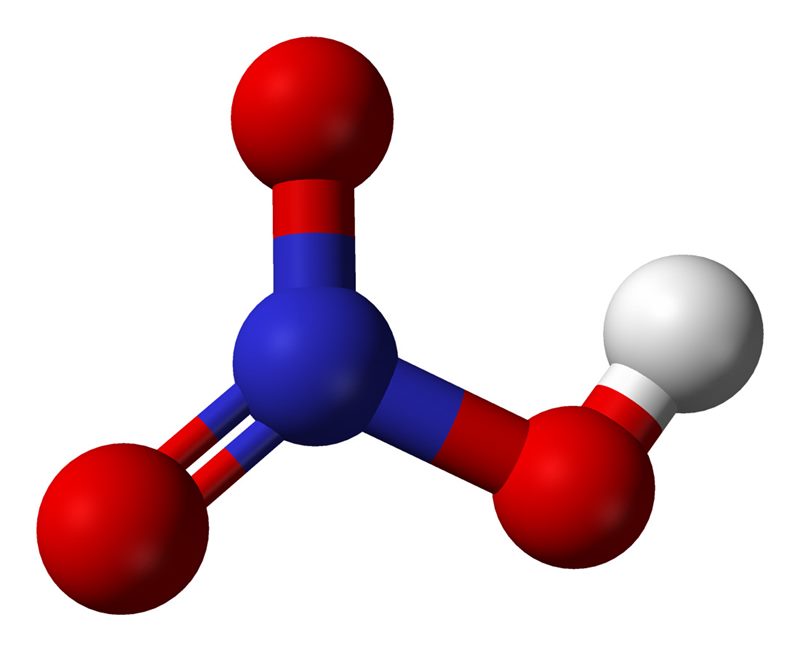
hno3 имеет один атом азота (синий), один атом водорода (белый) и три атома кислорода (красный). атом азота связан со всеми тремя атомами кислорода и несет заряд +1. один атом кислорода несет заряд -1, один связан с водородом, а другой образует двойную связь с азотом.
поскольку кислород имеет большую тенденцию притягивать к себе общие электроны, чем азот, он несет отрицательный заряд, а атом азота несет положительный заряд.
Структура Льюиса
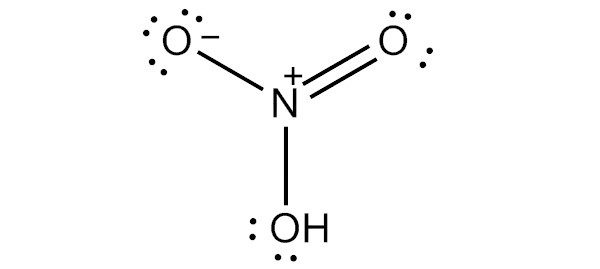
чтобы нарисовать льюисовскую структуру азотной кислоты, нам нужно подсчитать общее количество валентных электронов в молекуле hno3.
- валентный электрон в одном атоме азота = 5
- валентный электрон в одном атоме водорода = 1
- валентный электрон в трех атомах кислорода = 18 (6*3)
это дает нам общее количество валентных электронов (5 + 1 + 18) в одной молекуле hno3. поскольку у азота больше валентных электронов, чем у кислорода, мы можем поместить атом азота в центр структуры.
следующим шагом является формирование связи и маркировка одиночной пары на атомах. затем идет заряд каждого атома: атом азота получит заряд +2, а два атома кислорода — заряд -1.
наконец, нам нужно минимизировать заряды на атомах, чтобы сделать структуру стабильной. это может быть сделано путем преобразования одинокой пары на одном атоме кислорода в связь. конечная структура состоит из двух одиночных связей между атомом азота и двумя атомами кислорода, а также двойной связи между атомом азота и оставшимся атомом кислорода.
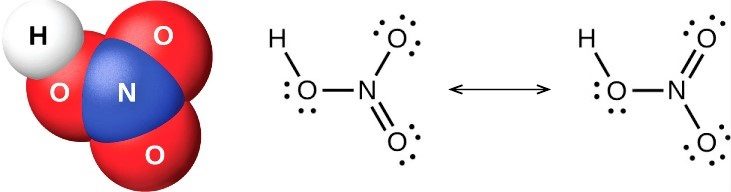
есть два правильных способа нарисовать структуру льюиса hno3. таким образом, он имеет две основные формы резонанса. двунаправленная стрелка на изображении выше указывает на то, что существует более одного способа нарисовать структуру азотной кислоты.
Физические и химические свойства
водные растворы hno3:
- «дымящая азотная кислота» обладает массовой долей 0,95 — 0,98;
- концентрированная азотная кислота характеризуется массовой долей 0,6 — 0,7.
в водной среде образуется азеотропная смесь. в процессе кристаллизации азотной кислоты из водных растворов формируются кристаллогидраты:
- моногидрат hno3·h2o с температурой плавления −37,62 °c;
- тригидрат hno3·3h2o с температурой плавления −18,47 °c.
азотная кислота в твердом агрегатном состоянии способна образовывать следующие кристаллические модификации:
- моноклинная сингония;
- ромбическая.
формула

водные растворы азотной кислоты обладают определенной плотностью, которая является функцией ее концентрации и определяется с помощью уравнения:
d(c)=0,9952+0,564c+0,3005c2-0,359c3,d(c)=0,9952+0,564c+0,3005c2-0,359c3,
где d — плотность в г/см3, c — массовая доля кислоты.
в том случае, когда требуется описать изменение плотности при концентрации азотной кислоты выше 97%, точность расчетов по данной формуле значительно снижается.
свойства
физические свойства азотной кислоты:
- жидкое агрегатное состояние при нормальных условиях;
- малярная масса 63,012 г/моль;
- плотность 1,513г/см3;
- температура плавления −41,59 °c;
- температура кипения 82,6 °c.
высококонцентрированная hno3 в большинстве случаев обладает бурой окраской. цвет обусловлен процессом разложения, который протекает на свету:
4hno3⟶4no2 ↑+2h2o+o2 ↑
в процессе повышения температуры вещество распадается аналогично записанному уравнению. исключить разложение при перегонке азотной кислоты можно, если создать среду с пониженным давлением. частичное разложение азотной кислоты происходит в процессе кипения или под действием света.
hno3, являясь сильной одноосновной кислотой, вступает в химические реакции с основными и амфотерными оксидами:
cuo+2hno3⟶cu(no3)2+h2o
zno+2hno3⟶zn(no3)2+h2o
азотная кислота взаимодействует с основаниями:
koh+hno3⟶kno3+h2o
азотная кислота способна вытеснять слабые кислоты из их солей:
caco3+2hno3⟶ca(no3)2+h2o+co2 ↑
при любой концентрации азотная кислота играет роль кислоты-окислителя. в процессе происходит восстановление азота до степени окисления от +5 до −3. то, насколько глубоко протекает восстановление, определяется по большей степени природой восстановителя и концентрацией азотной кислоты.
золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте. другие металлы вступают в химические реакции с азотной кислотой. ход такого взаимодействия зависит от концентрации кислоты. при взаимодействии металлов с азотной кислотой водород не выделяется.
являясь кислотой-окислителем, hno3 вступает в химические реакции с металлами, которые расположены в ряду напряжений правее водорода. в случае концентрированной азотной кислоты уравнение реакции примет вид:
cu+4hno3(60%)⟶cu(no3)2+2no2 ↑+2h2o
в том случае, когда в данной реакции участвует разбавленная кислота, процесс будет реализован по следующей схеме:
3cu+8hno3(30%)⟶3cu(no3)2+2no ↑+4h2o
азотная кислота взаимодействует с металлами, которые расположены в ряду напряжений левее водорода:
zn+4hno3(60%)⟶zn(no3)2+2no2 ↑+2h2o
3zn+8hno3(30%)⟶3zn(no3)2+2no ↑+4h2o
4zn+10hno3(20%)⟶4zn(no3)2+n2o ↑+5h2o
5zn+12hno3(10%)⟶5zn(no3)2+n2 ↑+6h2o
4zn+10hno3(3%)⟶4zn(no3)2+nh4no3+3h2o
записанные уравнения основаны лишь на доминирующем продукте реакции. это объясняется тем, что при созданных условиях продуктов данной реакции больше, чем продуктов других реакций. в качестве примера можно привести процесс химического взаимодействия цинка и азотной кислоты с массовой долей в растворе 30%. продукты такой реакции содержат больше всего no, в меньших количествах будут содержаться no2,n2o,n2 и nh4no3.
общую закономерность, которую можно наблюдать в процессе взаимодействия азотной кислоты с металлами, формулируют следующим образом: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты⇐no2,no,n2o,n2,nh4no3⇒ ⇐no2,no,n2o,n2,nh4no3⇒ увеличение активности металла
некоторые из металлов, в том числе, железо, хром, алюминий, кобальт, никель, марганец, бериллий, вступают в химические реакции с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и сохраняют стабильность при ее воздействии. азотная кислота в любой концентрации не вступает в химическое взаимодействие с такими металлами, как золото и платина. железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются.
разбавленная азотная кислота вступает в реакцию с железом. в результате образуются продукты восстановления азота и окисления железа:
fe+4hno3(25%)⟶fe(no3)3+no ↑+2h2o
4fe+10hno3(2%)⟶4fe(no3)2+nh4no3+3h2o
азотная кислота способна окислять неметаллы. в результате в большинстве случаев происходит восстановление азота до no или no2:
s+6hno3(60%)⟶h2so4+6no2 ↑+2h2o
s+2hno3(40%)⟶h2so4+2no ↑
p+5hno3(60%)⟶h3po4+5no2 ↑+h2o
3p+5hno3(30%)+2h2o⟶3h3po4+5no ↑
азотная кислота обладает свойством окислять сложные вещества:
fes+4hno3(30%)⟶fe(no3)3+s+no ↑+2h2o
определенные органические соединения, к примеру, амины и скипидар, могут самовозгораться в процессе реакции с концентрированной азотной кислотой.
смесь, в которую входят азотная и серная кислоты, называют «меланж». азотная кислота активно применяется в производстве нитросоединений.
реакция
в том случае, когда смешивают три объема соляной кислоты и один объем азотной кислоты, получается смесь под названием «царская водка». этот продукт способен растворять большинство металлов, включая золото и платину. свойства такого сильного окислителя объясняются формированием атомарного хлора и хлорида нитрозила:
3hcl+hno3 →150oc nocl+cl2 ↑+2h2o
химические реакции концентрированных азотной и соляной кислот с благородными металлами:
au+hno3+4hcl⟶h[aucl4]+no ↑+2h2o
3pt+4hno3+18hcl⟶3h2[ptcl6]+4no ↑+8h2o
азотная кислота не вступает в химические реакции со стеклом и фторопластом-4.
Получение
азотную кислоту впервые получили алхимики из селитры и железного купороса при термической реакции:
4kno3 + 2feso4 ∙ 7h2o → fe2o3 + 2k2so4 + 2hno3↑ + 2no2↑ + 6h2o.
в современной химии существуют лабораторные и промышленные способы получения азотной кислоты. в лабораториях кислоту получают путём нагревания смеси из нитратов и концентрированной серной кислоты:
kno3 + h2so4 → khso4 + hno3.
в промышленности азотную кислоту получают окислением аммиака. метод осуществляется в три этапа.
сначала аммиак окисляют на платиновых катализаторах до оксида азота (ii):
4nh3 + 5o2 → 4no + 6h2o.
это реакция необратима.
оксид азота (ii) или монооксид окисляют до диоксида или оксида азота (iv):
2no + o2 ↔ 2no2.
конечным этапом является поглощение диоксида азота водой в избытке кислорода:
4no2 + o2 + 2h2o ↔ 4hno3.
все реакции протекают с выделением тепла, т.е. являются экзотермическими. две последние реакции обратимы, поэтому итоговая концентрация чистой азотной кислоты невысока (45-58 %).
для повышения концентрации в реакции оксида азота (iv) с водой смещают равновесие, увеличивая давление. также разбавленную азотную кислоту могут смешивать с серной кислотой и нагревать. азотная кислота испаряется и конденсируется.
лабораторный метод получения азотной кислоты обнаружил немецкий алхимик иоганн рудольф глаубер в xvii веке.

Производство слабой азотной кислоты
большая часть азотной кислоты образуется в результате высокотемпературного каталитического окисления аммиака. это называется процессом оствальда. он состоит из трех этапов:
1) окисление аммиака
4 nh 3 + 5 o 2 → 4 no + 6 h 2 o
смесь аммиака и воздуха (1:9) окисляется до высокой температуры (750-800 ℃) при прохождении через каталитический преобразователь. катализатор обычно изготавливается из 90% платины и 10% родиевой сетки. эта (экзотермическая) реакция приводит к образованию оксида азота и воды в виде пара.
2) окисление оксида азота
2 no + o2 → 2 no2
окись азота, образовавшаяся в предыдущей реакции, окисляется: она некаталитически реагирует с остаточным кислородом с образованием диоксида азота. это медленная, однородная реакция, которая сильно зависит от давления и температуры. при высоком давлении и низких температурах эта реакция приводит к образованию максимального количества диоксида азота за очень короткое время.
3) поглощение
3 no2 + h2o → 2 hno3 + no
в конечной реакции оксид азота поглощается водой. это дает желаемый продукт (азотную кислоту в разбавленной форме) вместе с оксидом азота. концентрация hno 3 зависит от давления, температуры, количества стадий абсорбции, а также от концентрации оксидов азота, поступающих в абсорбер.
Производство сильной азотной кислоты
высокопрочная hno 3 получается путем концентрирования слабой hno 3 экстрактивной дистилляцией. дистилляция проводится в присутствии дегидратирующего агента, например 60% серной кислоты.
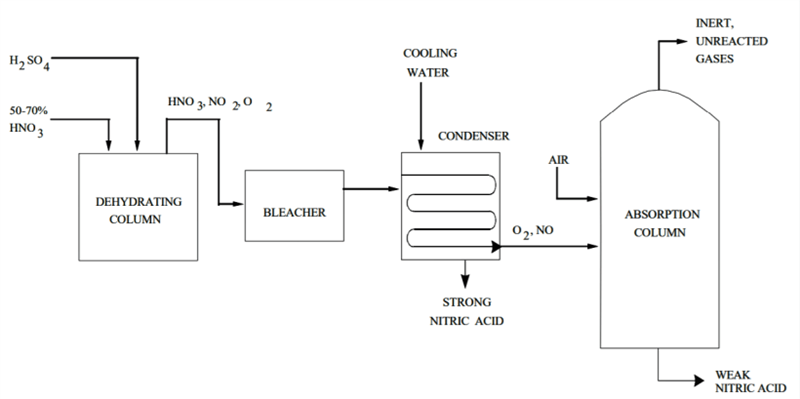
процесс протекает следующим образом: сильная серная кислота и слабая азотная кислота попадают в насадочную дегидратирующую колонну при атмосферном давлении. концентрированная hno 3 выходит из верхней части колонны в виде 99% пара. он также состоит из небольшого количества кислорода и оксида азота от диссоциации азотной кислоты.
кислота проходит через отбеливатель и попадает в систему конденсатора, который отделяет ее от оксида азота и кислорода. абсорбционная колонна забирает эти побочные продукты и объединяет оксид азота со вспомогательным воздухом для получения диоксида азота. этот газообразный диоксид азота затем рекуперируется в виде слабой hno 3, а небольшие непрореагировавшие и инертные газы выбрасываются в атмосферу.
Применение
химические и физические свойства азотной кислоты делают ее ценным веществом. она имеет несколько различных применений в различных областях, особенно в химической и фармацевтической промышленности.
удобрения: почти 80% производимой азотной кислоты используется для производства удобрений. точнее, она используется для производства аммиачной селитры (nh 4 no 3) и кальций-аммиачной селитры, которые находят применение в качестве удобрений.
hno 3 + nh 3 → nh 4 no 3
взрывчатые вещества: аммиачная селитра также используется в качестве взрывчатого вещества в горнодобывающей промышленности, гражданском строительстве, карьерах и других областях применения. примеры взрывчатых веществ, содержащих нитрат аммония, включают anfo, amatol и dbx.
красители и пластмассы: нитрат кальция и аммония используется в некоторых упаковках со льдом/гелем в качестве альтернативы аммиачной селитре. она также используется для производства химикатов и растворов, которые используются в производстве красителей и пластмасс.
ракетное топливо: красная и белая дымящаяся азотная кислота используется в жидкостных ракетах в качестве окислителя. во время второй мировой войны немецкие военные использовали дымящуюся красную азотную кислоту в нескольких ракетах.
деревообработка: очень слабая hno3 (с концентрацией 10%) используется для искусственного старения древесины сосны и клена. придает дереву винтажный вид с масляной отделкой.
другие применения: слегка концентрированный раствор под названием nital используется для травления металла, чтобы выявить его структуру на микроуровне. рефлюксная азотная кислота используется в процессах очистки углеродных нанотрубок. в электрохимии hno3 используется в качестве химического легирующего агента для органических полупроводников.
Действие на организм
азотная кислота ядовита. по степени воздействия на организм относится к веществам 3-го класса опасности. её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. при действии на кожу возникает характерное жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. при нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота no2 (газа бурого цвета).
Примеры решения задач
пример 1
| задание | вычислите рн 6,3×10-5м раствора азотной кислоты. |
| решение | известно, что водородный показатель вычисляется по формуле ph = -lg[h+]. при вычислении пользуемся таблицами четырехзначных логарифмов: рн = -lg(6,3×10-5) = 5 – 0,7993 = 4,2007. в нестепенном члене логарифмического числа содержатся две значащие цифры, поэтому округляем мантиссу до двух цифр: рн = 4,20. |
| ответ | pн раствора азотной кислоты равен 4,20. |
пример 2
| задание | составьте уравнение электронейтральности для водного раствора нитрата калия. |
| ответ | в водном растворе нитрата калия (kno3 – калиевая соль азотной кислоты) имеются ионы k+, no3— и ионы h3o+ и oh—, образующиеся при диссоциации воды. уравнение электронейтральности поэтому следует записать так: [k+] + [h3o+] = [no3—] + [oh—]. |