- История открытия
- Характеристики элемента
- Физические свойства
- Химические свойства
- Электронная схема алюминия
- Степень окисления алюминия
- Взаимодействие алюминия с простыми веществами
- с кислородом
- с галогенами
- с серой
- с азотом
- с углеродом
- Способы получения
- Сферы использования металла и его соединений
- Использование сложных солей алюминия на практике
- Вред алюминия и его опасные свойства
- Влияние на организм: последствия и осложнения
- Симптомы избытка алюминия
История открытия
в 16 веке знаменитый парацельс сделал первый шаг к добыче алюминия. из квасцов он выделил «квасцовую землю», которая содержала оксид неизвестного тогда металла. в 18 веке к этому эксперименту вернулся немецкий химик андреас маргграф. оксид алюминия он назвал «alumina», что на латинском языке означает «вяжущий». на тот момент металл не пользовался популярностью, так как не был найден в чистом виде.
долгие годы выделить чистый алюминий пытались английские, датские и немецкие учёные. в 1855 году в париже на всемирной выставке металл алюминий произвёл фурор. из него делали только предметы роскоши и ювелирные украшения, так как металл был достаточно дорогим. в конце 19 века появился более современный и дешёвый метод получения алюминия. в 1911 году в дюрене выпустили первую партию дюралюминия, названного в честь города. в 1919 из этого материала был создан первый самолёт.
Характеристики элемента
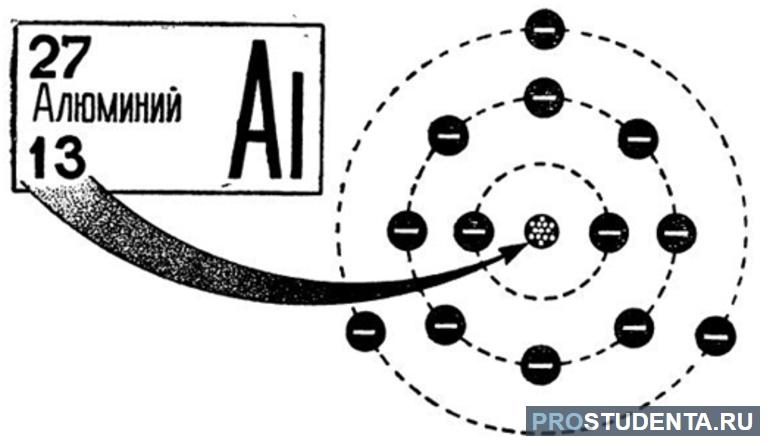
алюминий — элемент семейства лёгких металлов, уступающий в распространённости только кислороду и кремнию. в периодической таблице он располагается на тринадцатом месте, имеет серебристо-белый цвет. общепринятое химическое обозначение — al (от латинского слова aluminium).
вещество имеет следующие характеристики:
- относительная атомная масса — 26,981538. показывает, во сколько раз атом алюминия превышает вес атомной единицы массы, принятой равной 1,67 * 10-27 килограммов.
- атомный номер — 13. обозначает число протонов в ядре вещества равное количеству электронов, вращающихся вокруг атома.
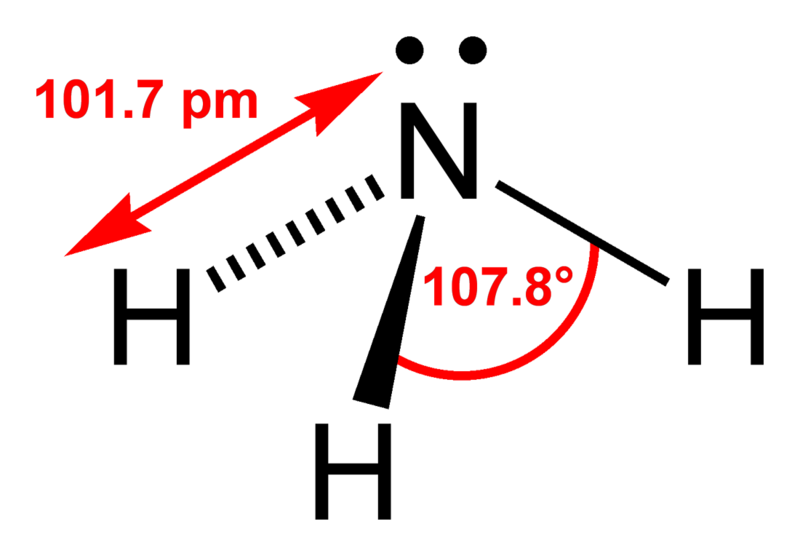
- радиус атома — 143 пикнометра. определяется расстоянием между ядром и самой удалённой орбитой элемента.
- ковалентный радиус — 121 пикнометр. расстояние между ядрами, формирующими ковалентную связь и делённое на 2.
- электронная формула атома алюминия — 1s 2 2s 2 2p 6 3s 2 3p 1. число электронов в оболочках в соответствии с энергетическим состоянием.
- фазовые температуры — при достижении 660 градусов по цельсию происходит плавление, а при 2518 °c закипание.
- способность атомов удерживать электроны (электроотрицательность) — 1,61 по полингу.
- степень окисления — 3,0. находится по числу электронов, смещённых от или к атому.
- плотность — 2,7 г/см3. отношение массы алюминия к его объёму.
- молярный объем = 10,0 см3/моль. определяется отношением объёма вещества к количеству.
в ядре вещества содержится 13 протонов и больше на один нейтронов. всего же массовое число равняется 27. электроны располагаются на трех энергетических уровнях. на первом размещены 2 электрона, на втором 8 (три пары), а на третьем 3. такое положение соответствует записи: +13al)2)8)3.
при этом если атом возбудить, то в этом состоянии все три элемента могут быть отданы, тем самым достигая степени окисления +3 или вызывать образование ковалентных связей. отсюда следует, что валентность алюминия равняется трём. в природе вещество встречается в глине, слюде, корунде. взаимодействует со многими элементами, а вот с водородом нет.
при соприкосновении с кислородом образует оксидную плёнку, препятствующую реакциям с водой и азотной и серной кислотой.
Физические свойства
металл алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. он хорошо поддаётся штамповке, ковке, волочению, прокатке. алюминий хорошо сваривается различными видами сварки. важным свойством является малая плотность около 2,7 г/см³. температура плавления составляет около 660°с.
механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла. основные естественные примеси – это кремний, железо, цинк, титан и медь.
по степени очистки различают алюминий высокой и технической чистоты. практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. чем чище металл, тем он дороже. технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции. металл высокой чистоты применяют в специальных целях.
по показателю электропроводности алюминий уступает только золоту, серебру и меди. а сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью. длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
теплопроводность алюминия повышается с увеличением чистоты металла. примеси марганца, магния и меди снижают это свойство. по показателю теплопроводности алюминий проигрывает только меди и серебру. благодаря этому свойству металл применяется в теплообменниках и радиаторах охлаждения.
алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. эти показатели значительно больше, чем у большинства металлов. чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. металл хорошо полируется и анодируется.
алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия. эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства. алюминий обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства
алюминий — это достаточно активный амфотерный металл. при обычных условиях прочная оксидная плёнка определяет его стойкость. если разрушить оксидную плёнку, алюминий выступает как активный металл-восстановитель. в мелкораздробленном состоянии и при высокой температуре металл взаимодействует с кислородом. при нагревании происходят реакции с серой, фосфором, азотом, углеродом, йодом. при обычных условиях металл взаимодействует с хлором и бромом. с водородом реакции не происходит. с металлами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
при условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. легко протекают реакции с разбавленными кислотами. реакции с концентрированной азотной и серной кислотой происходят при нагревании. алюминий легко реагирует со щелочами. практическое применение в металлургии нашло свойство восстанавливать металлы из оксидов и солей – реакции алюминотермии.
Электронная схема алюминия
al: 1s2 2s2 2p6 3s2 3p1
короткая запись:
al: [ne]3s2 3p1
одинаковую электронную конфигурацию имеют атом алюминия и +1si, +2p, +3s, +4cl
порядок заполнения оболочек атома алюминия (al) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
на подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
алюминий имеет 13 электронов, заполним электронные оболочки в описанном выше порядке:
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
- 6 электронов на 2p-подуровне
- 2 электрона на 3s-подуровне
- 1 электрон на 3p-подуровне
Степень окисления алюминия
атомы алюминия в соединениях имеют степени окисления 3, 1.
степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Взаимодействие алюминия с простыми веществами
с кислородом
при контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава al2o3, которая защищает алюминий от дальнейшего окисления. невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
4аl + 3о2 = 2аl2о3
с галогенами
алюминий очень энергично реагирует со всеми галогенами. так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. уравнение взаимодействия йода с алюминием:
2al + 3i2 =2ali3
с бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
2al + 3br2 = 2albr3
реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. алюминий эффектно сгорает в хлоре в соответствии с уравнением:
2al + 3cl2 = 2alcl3
с серой
при нагревании до 150-200 ос или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфидалюминия
с азотом
при взаимодействии алюминия с азотом при температуре около 800 oc образуется нитрид алюминия:
с углеродом
при температуре около 2000oc алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Способы получения
как мы уже выяснили, всё или почти всё, что из себя представляет природный алюминий, — это его оксид al2o3. алюминий — очень активный металл, поэтому его извлечь из оксида непросто. приведём некоторые цифры: энергия гиббса сродства к кислороду, то есть образования оксида, составляет около -300 кдж/моль! а электродный потенциал реакции восстановления алюминия(3+) составляет -1,7 в, что ставит его рядом с бериллием и марганцем.
поэтому одним из самых распространённых способов для его получения служит электролиз расплава.
сам оксид алюминия (корунд) чрезвычайно тугоплавкий, поэтому к нему добавляют гексафторалюминат натрия — природный минерал криолит.
он имеет формулу na3[alf6] — это комплексное соединение, которое можно получить из водного оксида алюминия по следующей реакции:
(2al(oh)_3 + 3na_2co_3 + 18hf = 2na_3[alf_6] + 3co_2uparrow + 9h_2o)
на территории россии криолит встречается в непригодном для получения алюминия виде (загрязнённом), поэтому для электролиза расплава его получают по вышеприведённой реакции.
вместе с ним к оксиду алюминия добавляют также фторид кальция caf2, и в результате смесь начинает плавиться при 950ос.
в расплавленную смесь погружают графитовые электроды и создают напряжение, в результате чего происходит процесс электролиза, который в данном случае точно описать довольно сложно, поэтому ограничимся приблизительными реакциями.
(al_2o_3 = alo^+ + alo_2^-) (quad ominus 3alo^+ + 3overline{e} = aldownarrow + al_2o_3) (quad oplus 2alo_2^- — 2overline{e} = [o] + al_2o_3)
вместе с этим графитовые электроды довольно быстро сгорают при такой высокой температуре и количестве кислорода, который выделяется на них:
(c + o_2 = co_2uparrow)
суммируя всё вышесказанное, в процессе электролиза расплава на катоде выделяется алюминий, который из-за большей, нежели расплав, плотности собирается на дне жидким слоем; на аноде же выделяется кислород.
Сферы использования металла и его соединений
значительное количество алюминия находится в фарфоре, кирпиче, цементе. по масштабам использования сплавы металла уступают место железу. широкое применение алюминиевых материалов в различных отраслях связано с рядом физических и химических параметров:
- невысокая плотность;
- металл не ржавеет, обладает устойчивостью к коррозии;
- имеет высокую электропроводность;
- легко поддается штамповке, прокату и обладает ковкостью;
- пластичен и прочен;
- на поверхности алюминиевых сплавов легко наносятся декоративные и защитные покрытия.
при добавлении разных лигатурных компонентов сплавы на основе алюминия приобретают новые свойства, формируя интерметаллические соединения или твердые растворы.
не все материалы способны образовывать оксидные пленки даже принудительно. для сохранения антикоррозионных свойств материала кислотно-щелочной баланс должен соответствовать диапазону от 6 до 8 единиц.
чистый алюминий практически не подвергается воздействию агрессивной среды. даже тонкое покрытие поверхности металлом без примесей способно предотвратить реакцию.
основную массу металла используют для получения легких сплавов:
- дюралюминия, в котором находится 94% алюминия, 4% меди, по 0,5% железа, марганца, кремния и магния;
- силумина — до 90% основа, до 14% кремний и натрий.
в металлургии химический элемент используют в качестве лигатурной добавки в составы на основе меди, никеля, железа, магния. такие соединения широко применяются в автомобилестроении, в быту, авиационной технике.
из сплава с основным содержанием алюминия был изготовлен первый искусственный спутник планеты земля. в виде порошка его используют как компонент ракетного топлива. эта идея принадлежит ф. а. цандеру. сплав металла с цирконием используют в строительстве ядерных реакторов, изготовлении взрывчатых материалов.
электрохимическим способом на поверхности ювелирной бижутерии наносят защитные окрашенные пленки, по внешнему виду напоминающие золото. сплав алюминия с золотом, обладающий насыщенным фиолетовым цветом, используют в качестве вставок в украшения.
при обращении с металлом в домашних условиях нужно соблюдать правила эксплуатации посуды из алюминия. чтобы продукты не окислились, то их стоит хранить в эмалированной или стеклянной посуде.
готовить в посуде из алюминия можно нейтральные жидкости, например, воду или молоко. кислые блюда реагируют с металлом и приобретают неприятный вкус в результате разрушения оксидной пленки.
металл можно расплавить в домашних условиях с целью изготовления различных деталей методом литья. в промышленном производстве в качестве материала для форм используют металл с высшей температурой плавления, а в кустарных условиях для этой цели применяют гипс.
Использование сложных солей алюминия на практике
сложные многоатомные соединения часто используются в фармацевтике, так как там нужно применять нестандартные подходы для поиска оптимального состава лекарственных препаратов. например, вещество алюминия гидроксид-магния карбонат магния-гидроксид представляет собой сложное многоатомное соединение, которое обладает большим набором полезных качеств.
его свойства можно изложить списком:
- является сильнейшим атацидным средством, так что может быстро успокаивать желудок при ощущении в нем дискомфорта после острой или кислой пищи.
- нейтрализует среду желудка, забирая на себя избыточную соляную кислоту.
- возвращает в норму кислотно-щелочной баланс.
алюминия гидроксида-магния карбоната гель-магния гидроксид прописывают пациентам при изжоге, повышенной кислотности желудка, хронических гастритах и язвенной болезни, грыже. также он позволит снять негативное воздействие алкоголя на организм после его злоупотребления.
при диетах или приеме других лекарств будет положительно влиять на желудок, так как избавит его от избыточной кислоты, которая всегда доставляет дискомфорт и приводит к болевым ощущениям и ухудшению самочувствия. противопоказаниями к применению выступают только болезнь альцгеймера и тяжелые нарушения функции почек, которые не позволяют им работать в полную силу.
побочные эффекты проявляются крайне редко и могут иметь вид тошноты, незначительной диареи или изменения вкусовых ощущений. также иногда пациенты чувствуют слабость быструю утомляемость или замедленную реакцию на окружающий мир. с другими лекарственными препаратами отмечается отличный уровень взаимодействия, но в любом случае нужно все делать только после консультации со своим лечащим врачом.
Вред алюминия и его опасные свойства
- вызывает нейродегенеративные заболевания. главная мишень компонента — нервная система. его высокие концентрации были обнаружены в тканях головного мозга у пациентов с болезнью альцгеймера. ученые пришли к выводу, что этот вид деменции появился в результате изменения условий жизни и связан с индустриализацией.
- опасен для людей с почечной недостаточностью. если почки плохо работают, элемент не выводится и накапливается в тканях. исследования показали, что с этим часто сталкиваются люди, у которых диагностирована почечная недостаточность.
- поражает кости. металл всасывается в кишечнике и быстро транспортируется в кости, нарушая их минерализацию, рост и активность костных клеток. его токсическое действие носит кумулятивный характер и даже прерывистый или низкодозированный прием токсина увеличивает общую нагрузку на костную систему.
- снижает когнитивные функции. исследования подтвердили, что у работников заводов, контактирующих с алюминием, снижаются умственные функции. чем больше металла и дольше его воздействие, тем хуже внимание и память.
Влияние на организм: последствия и осложнения
побочные эффекты связаны с высоким уровнем металла, плохим состоянием здоровья. последствия определяются количеством, продолжительностью и способом воздействия.

Симптомы избытка алюминия

- спутанность сознания;
- мышечная слабость;
- боль в костях;
- судороги;
- проблемы с речью;
- замедленное развитие у детей;
- проблемы с легкими;
- проблемы с нервной системой — энцефалопатия, когнитивные и двигательные расстройства;
- нарушение всасывания железа, анемия;
- заболевания головного мозга;
- иммунные и аллергические реакции.