Строение
аммиак (нитрид водорода) — является бинарным неорганическим химическим соединением азота и водорода.
формула аммиака в химии:
nh3
строение молекулы:
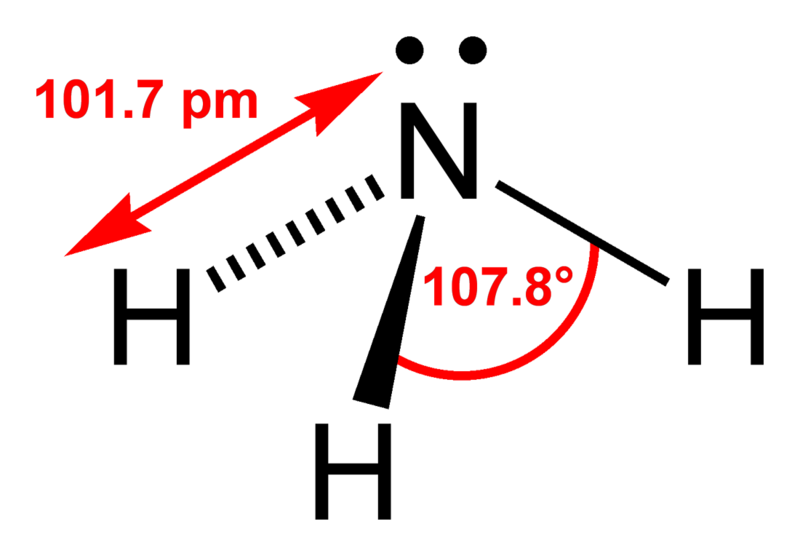
в молекуле аммиака nh3 атом азота образует три одинарных ковалентных полярных связи с атомами водорода.
схема образования молекулы:
молекула аммиака с точки зрения геометрической формы представляет собой правильную треугольную пирамиду. валентный угол h-n-h составляет 107,30.
атом азота в аммиаке на внешнем энергетическом уровне содержит одну неподеленную электронную пару. данная электронная пара существенно влияет на свойства соединения и определяет его структуру. электронная структурная схема аммиака представляет собой тетраэдр, содержащий атом азота в центре, а в одной из вершин располагается неподеленная электронная пара:
в обычном состоянии аммиак является газом без цвета и с резким специфическим запахом. молярная масса вещества составляет 17,0306 г/моль. аммиак меньше по весу, чем воздух. связь n-h является сильно полярной, что объясняет возникновение водородных связей между молекулами аммиака в жидкой фазе. при этом вещество характеризуется высокой степенью растворимости в воде. данный факт объясняется образованием водородных связей между молекулами аммиака и молекулами воды.
молекула аммиака состоит из одного атома азота и трёх атомов водорода. связи между атомами водорода и азота ковалентные. молекула аммиака имеет форму тригональной пирамиды.
на 2р-орбитали азота находится три свободных электрона. с ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
если один атом водорода заменить углеводородным радикалом (cnhm), получится новое органическое вещество – амин. замещаться может не только один атом водорода, но и все три. в зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – ch3nh2);
- вторичные (диметиламин – сн3-nh-сн3);
- третичные (триметиламин – сн3-n-(сн3)2).
к молекуле аммиака могут присоединиться с2н4, с6н4, (с2н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

у аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Происхождение аммиака

история открытия натурального газа аммиака имеет две легенды. по первой легенде, около храма египетского бога амона, где совершались религиозные обряды, люди нюхали пары верблюжьих экскрементов, от чего впадали в транс. эти пары назвали «аммиак».
по второй легенде, в северной африке в районе оазиса аммона находилось пересечение караванных путей. там проходило огромное количество животных, дорога была усеяна их калом и обильно полита мочой, которые испарялись и выделяли газ, который называли «аммиак».
что касается научного открытия газа с названием «аммиак», то оно датируется 1785 годом. химическую формулу газа, nh3, определил французский ученый к. л. бертолле и назвал его «аммиак».
но еще в 1774 году английский ученый д. пристли получил идентичный газ, которому дал название «щелочной воздух», но химического состава вывести не смог.
аммиак (ammonia на латыни) — бесцветный газ со специфическим запахом, легче воздуха, химически активный, сжижается при температуре -33 с; хорошо растворяется в воде, имеет щелочную реакцию; взаимодействует с соляной кислотой и образует соль аммония: nh3 + hcl = nh4cl, которая при нагревании разлагается: nh4cl = nh3 + hcl.
получают аммиак двумя способами — промышленным и лабораторным. при лабораторном способе аммиак получается при нагревании щелочей и соли аммония:
- nh4cl + koh = nh3 ↑ + kcl + h2o;
- nh4 + + oh — = nh 3 ↑ + h2o.
в промышленных условиях аммиак сначала производится в газообразном виде, а затем его сжижают и доводят до 25%-го водного раствора, который называется аммиачная вода.

синтез аммиака — это очень важное химическое производство, так как аммиак является основополагающим элементом для многих других химических технологий и производств. так, аммиак используется в промышленных холодильных установках в качестве хладагента; является отбеливателем при обработке и крашении тканей; незаменим в процессе производства азотной кислоты, азотных удобрений, солей аммония, синтетических волокон — нейлона и капрона.
промышленный способ синтеза аммиака был изобретен в 1909 году немецким химиком фрицем габером. в 1918 году за свое открытие в химии он получил нобелевскую премию. первый завод по производству аммиака был запущен в 1913 году в германии, а в 1928 году производство аммиака было уже налажено в россии.
Физические свойства
основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°с, при 0°с – 1200);
- легче воздуха.
аммиак сжижается при температуре -33°с и становится твёрдым при -78°с. концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
в природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические свойства
рассмотрим контактное окисление аммиака до оксида азота. типичные химические реакции с аммиаком без изменения степени окисления азота:
- реакция с водой: nh₃ + h₂o = nh₄oh = nh₄⁺ + он⁻ (реакция обратима, так как гидроксид аммония nh₄oh — это нестойкое соединение).
- реакция с кислотами с образованием нормальных и кислых солей: nh₃ + hcl = nh₄cl (нормальный хлорид аммония соли сформирован);nh₃ + h₂so₄ = nh₄hso₄ (в реакции аммиака с холодной концентрированной серной кислотой образуется кислотная соль гидросульфат аммония); 2nh₃ + h₂so₄ = (nh₄)₂so₄.
- реакции с солями тяжелых металлов с образованием комплексов: 2nh₃ + agcl = [ag(nh₃)₂]cl (сложные соединения серебра (i) хлоридные формы диамина).
- реакция с haloalkanes: nh3 + ch3cl = [ch3nh3]cl (формы гидрохлорида метиламмония – это замещенный ион аммония nh4=).
- реакция со щелочными металлами: 2nh₃ + 2k = 2knh₂ + h₂ (образуется амид калия knh₂; азот не изменяет состояние окисления, хотя реакция окислительно-восстановительная). реакции присоединения происходят в большинстве случаев без изменения состояния окисления (все вышеперечисленные, кроме последней, классифицируются данным типом).

Как получить аммиак

существуют два основных практических метода получения аммиака: один в лаборатории, другой — в промышленности.
рассмотрим получение аммиака в промышленности. взаимодействие молекулярного азота и водорода: n₂ + 2h₂ = 2nh₃ (обратимая реакция). этот метод получения аммиака называется реакцией хабера. для молекулярного азота и водорода, которые должны прореагировать, их необходимо нагреть к 500 ᵒc или 932 ᵒf, давлению mpa 25-30 необходимо создаться. пористый утюг должен присутствовать как катализатор.
получение в лаборатории – это реакция между хлоридом аммония и гидроксидом кальция: са(oh)₂ + 2nh₄cl = cacl₂ + 2nh₄oh (как nh₄oh — очень слабое соединение, оно сразу же распадается на газообразный аммиак и воду: nh₄oh = nh₃ + h₂o).
В промышленности
аммиак промышленным путём получают из азота, соединяя его с водородом. азот берут из воздуха, водород – из воды. впервые метод разработал немецкий химик фриц габер. промышленный способ получения аммиака стали называть процессом габера.
реакция проходит с уменьшением объёма и выделением энергии в виде тепла:
3h2 + n2 → 2nh3 + q.
реакция обратима, поэтому необходимо соблюсти несколько условий. при высоком давлении и низких температурах объём полученного аммиака увеличивается. однако низкие температуры замедляют скорость реакции, а повышение температуры способствует увеличению скорости обратной реакции.
опытным путём были найдены необходимые условия для проведения реакции:
- температура – 500°c;
- давление – 350 атм;
- катализатор – оксид железа fe3o4 (магнетит) с примесями оксидов серебра, калия, кальция и других веществ.
при таких условиях получившийся газ содержит 30 % аммиака. чтобы избежать обратной реакции, вещество быстро охлаждают. при низких температурах получившийся газ превращается в жидкость. неизрасходованные газы – азот и водород – возвращаются обратно в колонну для синтеза. такой способ помогает быстро получить большие объёмы аммиака, максимально используя сырьё.
чтобы найти нужный катализатор, было испробовано 20 тысяч разных веществ.
В лаборатории
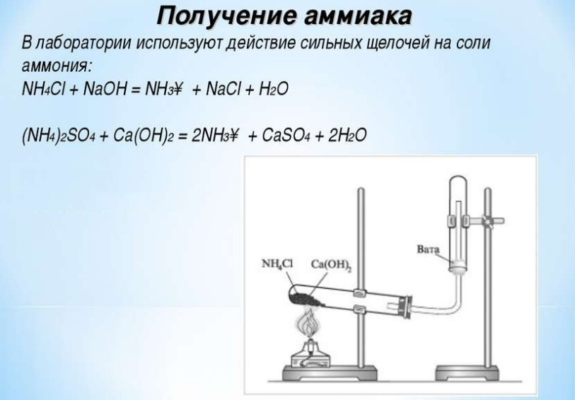
для получения аммиака в лаборатории используется реакция щелочей на соли аммония:
nh4cl + naoh → nh3↑ + nacl + h2o
также аммиак лабораторным путём можно получить из хлорида аммония, нагретого вместе с гашёной известью, или разложением гидроксида аммония:
- 2nh4cl + ca(oh)2 → cacl2 + 2nh3 + 2h2o;
- nh4oh ↔ nh3↑ + h2o.
полностью осушить аммиак можно с помощью смеси извести с едким натрием, через которую пропускают полученный газ. для этой же цели жидкий аммиак смешивают с металлическим натрием и подвергают дистилляции.
аммиак легче воздуха, поэтому для его сбора пробирку держат вверх дном.
Области применения
область применения аммиака и аммиачного спирта широка, он используется практически во всех сферах жизнедеятельности человека, начиная от технологических процессов и заканчивая медициной и бытовыми нуждами.
Применение аммиака
аммиак широко применяется в качестве хладагента в различном бытовом и промышленном оборудовании.
он является одним из важнейших продуктов, используемых в химической промышленности. в частности, его используют в производстве:
- нашатырного спирта;
- добавок в строительные материалы для использования в морозных условиях;
- полимеров, соды и азотной кислоты;
- удобрений;
- взрывчатых веществ.
Использование аммиачного спирта
аммиачный спирт применяется в медицине и в быту.
применение в медицине показано в следующих случаях:

- для возбуждения дыхания при обморочных состояниях: для этого подносят к носу пострадавшего флакон с нашатырным спиртом; флакон надо держать в 5 см от носа, чтобы избежать ожога;
- для стимуляции рвоты при различных видах отравления: 10 капель на стакан воды и дать выпить;
- наружно для местного охлаждения при болях от невралгии или миозитов;
- наружно при зуде от укусов насекомых: сделать раствор из спирта с водой в пропорции 1 часть спирта на 10 частей воды и протереть зудящее место;
- наружно для обработки рук хирурга в качестве антисептика;
- внутрь при отравлении алкоголем: на 1 стакан воды 5 капель спирта. это позволяет быстро очнуться, собраться с мыслями и адекватно отвечать на вопросы;
- в качестве антисептика для стерилизации игл при отсутствии автоклава или разовых игл;
- для удаления бородавок: неразбавленным спиртом смочить ватный тампон и прижить к бородавке на 5−6 секунд, не дотрагиваясь до здоровой кожи, чтобы избежать ожога;
- в стоматологии в определенной концентрации при обработке полости рта;
- и в других случаях.
применение в быту заключается в обезжиривании и чистки различной домашней утвари.

раствором спирта из расчета 2 ч. л. на 2 стакана воды и 1 ст. л. любого средства для мытья посуды можно отлично почистить столовое серебро, серебряные и золотые ювелирные украшения (изделия с жемчугом нашатырным спиртом чистить нельзя, он станет серым и мутным). для этого надо поместить в раствор столовое серебро или ювелирные изделия, подержать от 1 до 2 часов, затем прополоскать в воде и насухо вытереть.
он хорошо выводит пятна крови, мочи и пота с шерсти, шелка и лайкры. в качестве пятновыводителя используется 50% раствор. в концентрированном виде может удалить следы от карандаша на одежде.
с ковров, мебельной обивки и автомобильных чехлов можно удалить пятка раствором из 1 ст. л. чистого аммиака и 2 л горячей воды. для этого надо прочистить загрязнение и дать просохнуть. если будет необходимость, то можно повторно прочистить.
оконные стекла, зеркала и фаянс тоже можно почистить раствором из 1 ст. л. чистого аммиака и 3 ст. воды. поверхность будет чистая и хорошо блестеть.
аммиачной водой 1 ст. л. в смеси с 4 л воды можно отчистить каменные налеты в ванне и умывальнике. для этого надо их прочистить раствором, а потом промыть горячей водой.
спирт может использоваться в садоводстве для борьбы с луковой мухой и тлей, а также в качестве удобрения, для огородных и комнатных растений в условиях кислой почвы.
Применение аммиачной воды
выпускается две марки аммиачной воды:
- а – для различных отраслей промышленности
- б – для сельского хозяйства в качестве азотного удобрения. [2] (в данный момент отствует в списке разрешенных к применению).
Сельское хозяйство
аммиачная вода вносится при основном приеме под зяблевую вспашку, а весной – под предпосевную культивацию, а также для подкормки пропашных культур.
зарегистрированые и допущеные к использованию на территории россии, в качестве удобрения, марки суперфоски находятся в таблице справа.
Промышленность
аммиачная вода используется в химической промышленности для производства азотных удобрений, азотной кислоты, полимеров, соды, взрывчатых веществ, при производстве красителей, в электролитическом производстве mn, ферросплавов. в холодильной технике это вещество применяется в качестве хладагента, а при производстве кормов – для их аммонизации.
Медицина
аммиачная вода в 10%-ной концентрации известна под названием нашатырный спирт, широко применяющийся в медицине.
Поведение в почве
при внесении аммиачной воды в почву аммиак адсорбируется почвенными коллоидами, поэтому его передвижение незначительно. впоследствии аммиачный азот нитрифицируется, приобретает большую степень подвижности и мигрирует с почвенным раствором.
внесение аммиачной воды повышает количество почвенных микроорганизмов, поскольку аммиак увеличивает количество растительных остатков, которыми питаются микроорганизмы. при этом непосредственно после внесения удобрения в почву в зоне его распространения наблюдается уменьшение количества почвенных микроорганизмов. после превращения аммиака в нитраты (это происходит весной за шесть недель) микроорганизмы сразу же размножаются в удобренной почве. аммиачная вода убивает и дождевых червей. однако их количество тоже быстро восстанавливается и даже увеличивается после превращения аммиака в нитраты или поглощения его растениями.
аммиачная вода подкисляет почву. для нейтрализации 1 ц аммиачной воды требуется 0,3–0,4 ц карбоната кальция.
| календарь применения | |
| апрель | основное внесние |
| май | припосевное внесние |
| июнь | подкормки |
| июль | подкормки |
| август | подкормки |
| сентябрь | основное внесние |
Применение на различных типах почв
аммиачная вода рекомендуется к применению на всех типах почв. высокая эффективность удобрения наблюдается на тяжелых высокогумусированных и хорошо обработанных почвах, где аммиак поглощается лучше, чем на легких почвах, бедных гумусом. из почв легкого механического состава и сухих аммиак улетучивается быстрее.
наибольший эффект от внесения аммиачной воды наблюдается при одновременном внесении с ней органических удобрений. не рекомендуется вносить аммиачные удобрения на одном участке подряд несколько лет, поскольку они усиливают минерализацию органического вещества почвы, а это приводит к снижению содержания органики в почве.
на связных почвах аммиачную воду рекомендуют вносить осенью как основное удобрение практически под все культуры при температуре почвы +10°c или весной перед посевом. на почвах легкого гранулометрического состава аммиачная вода вносится весной.