- Галогены — семейство химических элементов
- Положение галогенов в периодической системе и строение атомов
- Электронное строение галогенов
- Особенности атомной и молекулярной структуры галогенов
- Галогены – простые вещества
- Распространение в природе
- Распространённость элементов и получение простых веществ
- Физические свойства
- Химические свойства галогенов
- Химические свойства галогенов и их соединений с точки зрения изменения степеней окисления
- Биологическая роль галогенов
- Применение
- Получение галогенов
- Получение хлора
- Получение брома и иода
- Получение фтора
- Галогеноводороды
- Соединения галогенов с водородом
- Хлороводород, соляная кислота и их свойства
- Кислородсодержащие соединения галогенов
- Кислородные соединения брома и иода
- Примеры реакций галогенов с металлами
- Примеры решения задая
Галогены — семейство химических элементов
Галогены — химические элементы 17-й группы периодической таблицы химических элементов Д. И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы).
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается.
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент Теннесин Ts. Все галогены — неметаллы, являются сильными окислителями. На внешнем энергетическом уровне 7 электронов. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены (кроме фтора) при взаимодействии с более электроотрицательными элементами могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7. (Иногда употребляется устаревшее название гало́иды)

Положение галогенов в периодической системе и строение атомов
Слово «галоген» произошло от греческих «хальс» –соль и «генос» –рождаю, буквально: рождающий соль.
Это название изначально было предложено для хлора, так как хлор был получен электролизом поваренной соли.
А уже в дальнейшем это название распространилось на фтор F, бром Br и йод I.
Таким образом, галогены – это химические элементы главной подгруппы VII группы периодической системы химических элементов:
- фтор F
- хлор Сl
- бром Вг
- йод I
- астат At
Галогены – элементы, у которых наиболее ярко выражены свойства неметаллов.
В свободном виде они в природе не встречаются!
Наиболее распространенные минералы, в состав которых входят галогены:
CaF2– флюорит (плавиковый шпат)
NaCl– галит (каменная соль)
КСl х NaCl– сильвинит
MgCl2 х 6Н20 – бишофит.
Бром Br и йод I встречаются в виде соединений в природных водах.
Морские водоросли ламинарии активно накапливают йод и поэтому являются источником для его получения.
Астат At – радиоактивный элемент и поэтому его свойства не изучены.
Название «астат» переводится с греческого языка «неустойчивый».
Он был предсказан ещё Дмитрием Менделеевым, который назвал его «эка-йод».
По оценкам учёных, во всей земной коре этого элемента насчитывается около 1 грамма (!), он постоянно образуется в процессе распада урана, но и столь же быстро распадается.
На внешнем энергетическом уровне у всех атомов галогенов по семь электронов.
Этим объясняется общность их свойств.
Атомы галогенов легко присоединяют по одному электрону, проявляя в соединениях степень окисления -1.
Однако эти элементы, за исключением фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7.
Разнообразие значений степеней окисления объясняется электронным строением атомов, а точнее, внешними электронами.
Из электронного строения атома фтора следует, что фтор может принять только один электрон на 2s-подуровень.
Поэтому он одновалентен и его степень окисления всегда -1.
Кроме того, это самый электроотрицательный элемент – ни один другой элемент просто-напросто не способен отнять у атома фтора электрон.
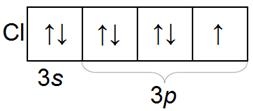
Атом хлора Cl в обычном состоянии имеет один электрон и может принять один электрон, проявляя степень окисления -1.
Однако у атома хлора имеется еще пять пустых 3d-орбиталей, и поэтому, если сообщить атому энергию, то возможен перескок электронов c 3s и 3p орбиталей на 3d орбитали, и тогда количество неспаренных электронов увеличивается и может быть 3, 5 или 7.
Поэтому возможные степени окисления хлора: +1, +3, +5, +7.
На схеме ниже показано электронное строение атома хлора в основном и в возбужденном состояниях.
Из схемы видно, почему максимальная валентность хлора равна 7.
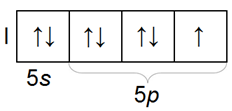
Электронное строение галогенов
Электронная конфигурация галогенов в основном состояниисоответствует формуле ns2np5.
Например, электронная конфигурация фтора:

Электронная концигурация хлора:
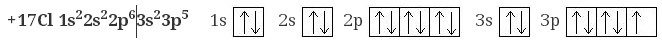
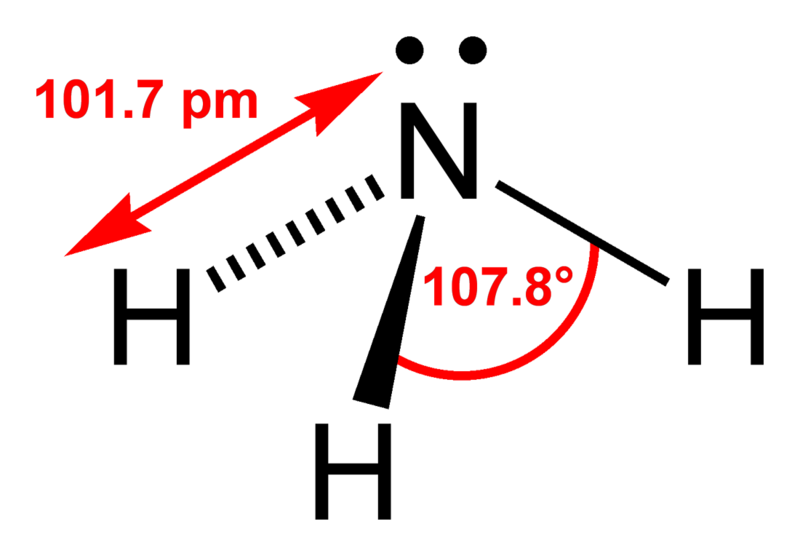
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентностьфтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Особенности атомной и молекулярной структуры галогенов
Элементы группы галогенов очень сходны по свойствам, поэтому рассматриваются вместе. Несколько отличен от других фтор. «Галогены» в переводе означает «солероды». Действительно, все галогены — фтор F, хлор Сl, бром Вr и иод I — при непосредственном взаимодействии с металлами образуют соли. Галогеном является и астат At, открытый в 1940 г.
Электронные конфигурации галогенов: F — 1s22s22p5; Cl — 1s22s22p63s23p5; Br — 1s22s22p63s23p63d104s24p5; I — 1s2s22p63s23p63d104s24p64d105s25p5.
Распределение электронов по энергетическим уровням галогенов в зависимости от заряда ядра Таблица 11
| Галоген | Атомный вес | Заряд ядра | Число электронов | Величина атомного радиуса,Å | ||||
| К | L | М | N | О | ||||
| Фтор FХлор СlБром ВгИод I | 18,9835,4579,90126,90 | +9+ 17+ 35+53 | 2222 | 7888 | 71818 | 718 | 7 | 0,710,991,141,33 |
Распределение по орбиталям электронов внешнего электронного слоя у всех галогенов однотипное
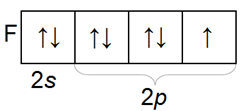
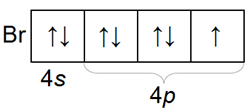
Галогены – простые вещества
В свободном состоянии молекулы галогенов состоят из двух атомов.
Некоторые физические свойства галогенов собраны в таблице.
| Галоген | Фтор | Хлор | Бром | Йод |
| Внешний вид | Бледно-желтый газ с резким запахом | Желто-зеленый газ с резким запахом | Коричневая жидкость с резким удушающим запахом | Тёмно-серые кристаллы |
| Относительная атомная масса | 19 | 35,4 | 79,9 | 126,9 |
| Температура плавления | –220 °С | –101 °С | –7 °С | 114 °С |
| Температура кипения | –188 °С | –35 °С | 59 °С | 184 °С |
| Растворимость в воде | Окисляет воду | Небольшая | Небольшая | Небольшая |
| Растворимость в органических растворителях | Окисляет растворитель | Небольшая | Хорошая | Хорошая |
Астат в связи с его очень большой скоростью радиоактивного распада не был получен в значительных количествах.
Водные растворы галогенов называют соответственно:
- хлорной водой
- бромной водой
- йодной водой
Все галогены ядовиты.
Физиологическое действие галогенов определяется сильными окислительными свойствами.
Особенно опасен фтор (F). При вдыхании даже небольших количеств фтора развивается отек легких, разрушается костная ткань.
Хлор (Cl) применялся как боевое отравляющее вещество во время Первой мировой войны. Отравление хлором вызывает легочные и бронхиальные заболевания.
Токсичность йода (I) используется при хлорировании воды – одном из способов очистки питьевой воды и обеззараживания сточных вод.
Однако в последнее время из-за токсичности хлора всё чаще применяют озонирование – обработку воды озоном.
Озон при разложении даёт кислород, который в небольших концентрациях не ядовит.
Пары брома (Br) вызывают удушье, головокружение, головную боль. При попадании брома на кожу образуются сильные, не заживающие длительное время ожоги.
Наименее ядовит из галогенов йод (I), однако и с ним необходимо обращаться осторожно, так как вдыхание паров йода оказывает раздражающее действие на дыхательные пути, нервную систему.
Кристаллический йод также может вызвать ожог кожи. Именно из-за небольшой токсичности йод применяется как антисептик в медицине.
Галогены химически очень активны, реагируют с очень многими простыми и сложными веществами.
С водородом они образуют бинарные соединения: HF, HCl, HBr, HI
Это ядовитые газы с резким запахом, напоминающим запах соответствующих галогенов.
Эти газы хорошо растворяются в воде и диссоциируют на ионы, образуя кислоты, которые реагируют с металлами с образованием галогенидов и выделением водорода.
Первые две кислоты используются больше двух других и поэтому имеют собственные названия:
хлороводородная кислота HCl (соляная)
фтороводородная кислота HF (плавиковая)
Своё название они получили из-за того, что хлороводородная кислота HCl (соляная) образует поваренную соль:
фтороводородная кислота HF (плавиковая), хотя и не очень сильная именно как кислота, но способна растворять стекло: фтор в составе кислоты вытесняет кислород из оксида кремния (основного компонента стекла):
Это свойство плавиковой кислоты используется при нанесении надписей и рисунков на стекло.
Галогены активно реагируют с металлами, образуя соли:
- фториды
- хлориды
- бромиды
- йодиды
При повышенной температуре хлор реагирует с медью, железом и некоторыми другими не очень активными металлами.
Металлы, как правило, горят в галогенах ярким пламенем с образованием большого количества искр.
Интересна реакция горения алюминия в броме.
Реакция сопровождается выделением большого количества энергии. Образующийся бромид алюминия сразу же гидролизуется во влаге воздуха с образованием большого количества дыма – выглядит это очень эффектно.
Тем не менее, хлор вполне можно хранить в стальных баллонах, потому что при отсутствии влаги реакция не идёт – главное, чтобы хлор был сухим. Баллоны с хлором окрашивают в зеленый цвет с тёмно-зеленой полосой или в желтый цвет с зеленой полосой
Большинство неметаллов непосредственно взаимодействуют с галогенами.
С хлором и бромом энергично взаимодействуют сера и фосфор:
Галогены взаимодействуют и со сложными веществами (водой, сероводородом).
Причем активность галогенов в подгруппе убывает сверху вниз.
Если вам когда-нибудь зададут вопрос: «А может ли гореть вода?» – смело отвечайте: «Да, может».
Всё дело в том, что более сильный окислитель вытесняет более слабый из его соединений.
Точно также происходит и с водой, если на неё воздействовать фтором (фтор – более сильный окислитель, чем кислород).
В атмосфере фтора вода в прямом смысле горит.
Химическая реакция горения воды в струе фтора выглядит так:
Галогены также способны вытеснять друг друга из солей – более активный элемент вытесняет менее активный.
На этом основан промышленный метод получения йода: хлор пропускают через насыщенный раствор морской соли, который содержит большое количество йодидов, и йод выделяется в виде простого вещества:
Распространение в природе
Так как галогены являются сильными окислителями, в свободном состоянии в природе они не встречаются и находятся в основном в виде химических соединений (табл. 23).
Таблица 23
Распространение галогенов в природе
| Химический элемент | Количество в земной коре, % | Природные соединения |
| Фтор | 0,027 | Плавиковый шпат  , апатит, фосфориты |
| Хлор | 0,045 | Хлориды: КС1, NaCl |
| Бром | 0,00016 | Бромиды: NaBr, KBr, MgBr,  |
| Йод | 0,00003 | Йодиды: NaJ, KJ |
Распространённость элементов и получение простых веществ
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов). Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF2).
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F−) = +2,87 В и Eo(Cl2/Cl−) = +1,36 В показывают, что окислить ионы F− и Cl− можно только сильными окислителями. В промышленности применяется только электролитическое окисление. При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na+ переходить из анодного пространства в катодное. Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl− в Cl2) и накапливаются у катода (образование −OH). Перемещение OH− в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH− реагировал бы с Cl2 и сводил на нет весь результат.
Бром получают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения иода из природных рассолов, богатых I−. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br2 и I2 удаляются из раствора потоком воздуха.
Физические свойства
Для галогенов характерна молекулярная решетка. С этим связаны низкие температуры плавления и кипения, которые по мере увеличения атомной массы повышаются.
В ряду химических элементов F-Cl-Br-I повышается плотность вещества. В нормальных условиях галогены выглядят следующим образом:
- фтор – светло-желтый газ;
- хлор – желто-зеленый газ;
- бром – оранжевая жидкость;
- йод – темно-фиолетовые кристаллы.
Галогены ядовиты и издают неприятный аромат. Они практически не растворимы в воде. Только фтор может реагировать с водой.
2F2 + 2H2O → 4HF + O2

Химические свойства галогенов
Радиусы атомов галогенов увеличиваются от фтора к йоду (в ряду 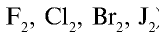
). Это объясняется тем, что валентные электроны фтора притягиваются к ядру сильнее, чем электроны йода.
В ряду 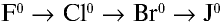
:
- — окислительные свойства галогенов ослабевают;
- — химическая активность снижается;
- — восстановительные свойства усиливаются.
В ряду 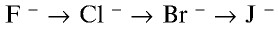
, наоборот, химическая активность галогенов возрастает. Внешний энергетический слой этих ионов заполнен восемью электронами, они не могут присоединять электроны, а наоборот, отдают их и окисляются.
Фтор — самый активный среди галогенов. Под влиянием фтора окисляется даже кислород. При взаимодействии с водой он горит ярким пламенем:
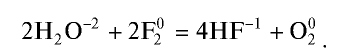
Элементы знаний, умений и навыков: галогены, сублимация.
Химические свойства галогенов и их соединений с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 1.1. Простые вещества
Водный раствор Cl2 окисляет соединения S–2 (H2S и сульфиды) до S+6, восстанавливаясь до степени окисления -1 (так как, находясь в седьмой группе периодической таблицы элементов, принять они могут только один электрон):
4Cl2 + H2S + 4H2O → H2SO4 + 8HCl
4Cl2 + Na2S + 4H2O → Na2SO4 + 8HCl
Br2 и I2 являются более слабыми окислителями и поэтому окисляют сероводород преимущественно до S:
Br2 + H2S → S
+ 2HBr.
Водные растворы Cl2 и Br2 окисляют соединения S+4 до S+6:
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
Br2 + SO2 + 2H2O → H2SO4 + 2HBr
Cl2 и Br2 окисляют аммиак с образованием хлорида и бромида аммония:
3Cl2 + 8NH3 → N2 + 6NH4Cl
3Br2 + 8NH3 → N2 + 6NH4Br
F2, Cl2 и Br2 окисляют пероксид водорода с образованием кислорода:
F2 + H2O2 → O2
+ 2HF
Cl2 + H2O2 → O2
+ 2HCl
Br2 + H2O2 → O2
+ 2HBr
F2, Cl2 и Br2 окисляют соединения железа, хрома, марганца и др. в промежуточных степенях окисления, преимущественно в щелочной среде:
3F2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KF + 8H2O
3Cl2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KCl + 8H2O
3Br2 + 2Fe(OH)3 + 10KOH → 2K2FeO4 + 6KBr + 8H2O
2Br2 + 2CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
3Br2 + 2NaCrO2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
3Cl2 + 2CrCl3 + 16KOH → 2K2CrO4 + 12KCl + 8H2O
3Br2 + Cr2(SO4)3 + 16NaOH → 2Na2CrO4 + 3Na2SO4 + 6NaBr + 8H2O
3Cl2 + 2K3[Cr(OH)6] + 4KOH → 2K2CrO4 + 6KCl + 8H2O
2Br2 + Mn(NO3)2 + 8NaOH → Na2MnO4 + 4NaBr + 2NaNO3 + 4H2O
F2 + NaBrO3 + 2NaOH → NaBrO4 + 2NaF + H2O
I2 + K2SO3 + 2KOH → K2SO4 + 2KI + H2O
Br2 + 2K2MnO4 → 2KMnO4 + 2KBr
Галогены также окисляют кислоты и кислотные оксиды, в которых неметалл имеет промежуточную степень окисления:
2Cl2 + H3PO2 + 7KOH → K3PO4 + 4KCl + 5H2O
2I2 + As2O3 + 5H2O → 2H3AsO4 + 4HI
F2 + KClO3 + 2NaOH → KClO4 + 2NaF + H2O.
Правило 1.2. Кислородсодержащие кислоты и соли хлора являются сильными окислителями.
При восстановлении любых соединений с положительными степенями окисления галогенов последние восстанавливается по максимуму, до Г– .
Восстановление кислот:
5HClO3 + 6P + 9H2O → 5HCl + 6H3PO4
2HClO3 + 3P2O3 + 9H2O → 2HCl + 6H3PO4
4HClO + PH3 → 4HCl + H3PO4
HClO3 + 6HBr → 3Br2 + HCl + 3H2O
HClO3 + 6HI → 3I2 + HCl + 3H2O.
Восстановление солей:
KClO4 + 8HI → KCl + 4I2 + 4H2O
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
2KClO3 + 3P2O3 → 2KCl + 3P2O5
KClO3 + 3H2O2 → KCl + 3O2 + 3H2O
NaClO3 + 3MnO2 + 6NaOH → 3Na2MnO4 + NaCl + 3H2O.
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
В щелочной среде соединения Fe, Cr и Mn окисляются до ферратов (FeO42–), хроматов (CrO42–) и манганатов (MnO42–), соответственно:
2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
KClO3 + 2CrCl3 + 10KOH → 7KCl + 2K2CrO4 + 5H2O
KClO3 + 2Cr(OH)3 + 4NaOH → KCl + 2Na2CrO4 + 5H2O
2KClO3 + 3MnO + 6KOH → 2KCl + 3K2MnO4 + 3H2O
KClO3 + 3MnO2 + 6KOH → KCl + 3K2MnO4 + 3H2O
NaClO3 + Cr2O3 + 2K2CO3 → NaCl + 2K2CrO4 + 2CO2
NaClO3 + Cr2O3 + 4NaOH → NaCl + 2Na2CrO4 + 2H2O.
Правило 1.3. При окислении галогенидов Г– как правило образуются простые вещества (Cl2, Br2 и I2).
Примеры реакций с Cl–, Br–, I– :
16HCl + 2KMnO4 → 5Cl2 + 2KCl + 8H2O + 2MnCl2
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
6HCl + KClO3 → 3Cl2 + KCl + 3H2O
2HCl + KClO → Cl2 + KCl + H2O
HCl + HClO → Cl2 + H2O
4HCl + PbO2 → Cl2 + PbCl2 + 2H2O
4HCl + Ca(ClO)2 → 2Cl2 + CaCl2 + 2H2O
14HI + K2Cr2O7 → 3I2 + 2CrI3 + 2KI + 7H2O
8HI + KClO4 → 4I2 + KCl + 4H2O
6KI + KClO3 + 3H2SO4 → 3I2 + 3K2SO4 + KCl + 3H2O
10KI + 2KMnO4 + 8H2SO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
2KI + MnO2 + 2H2SO4 → I2 + MnSO4 + K2SO4 + 2H2O
10KBr + 2KMnO4 + 8H2SO4 → 5Br2 + 2MnSO4 + 6K2SO4 + 8H2O
Правило 1.4. Только I– окисляется соединениями Fe+3 и Cu+2 :
6HI + 2Fe(OH)3 → I2 + 2FeI2 + 6H2O
6HI + Fe2O3 → I2 + 2FeI2 + 3H2O
6KI + 2FeBr3 → I2 + 2FeI2 + 6KBr
4HI + 2CuCl2 → I2 + 2CuI + 4HCl
4KI + 2CuSO4 → I2 + 2CuI + 2K2SO4
4KI + 2Cu(NO3)2 → I2 + 2CuI + 4KNO3
При взаимодействии HI с соединениями Fe+2 и Cu+1, а также других галогеноводородов с Fe+3 и Cu+2, идут обычные реакции ионного обмена:
HI + Fe(OH)2 → FeI2 + H2O
3HCl + Fe(OH)3 → FeCl3 + 3H2O
Правило 1.5. Ионы I– и Br– могут окисляться кислотами-окислителями:
8HI + H2SO4(к) → 4I2 + H2S
+ 4H2O
2HBr + H2SO4(к) → Br2 + SO2
+ 2H2O
8KI + 5H2SO4(к) → 4I2 + H2S
+ 4K2SO4 + 4H2O
2KBr + 2H2SO4(к) → Br2 + SO2
+ K2SO4 + 2H2O
2KI + 4HNO3(к) → I2 + 2NO2
+ 2KNO3 + 2H2O
2KBr + 4HNO3(к) → Br2 + 2NO2
+ 2KNO3 + 2H2O.
Биологическая роль галогенов
Галогены (в виде химических соединений, конечно) входят в состав организмов человека и животных, выполняя различные функции.
Они являются для организма жизненно важными элементами. Незначительные отклонения содержания микроэлементов от нормы вызывают тяжелые заболевания.
Фтор
В организме человека фтор содержится в волосах, ногтях, костях, зубной эмали.
В состав зубной ткани входит до 0,02 % фтора, который поступает в организм с питьевой водой.
Хорошая питьевая вода должна содержать около 2 мг фтора в литре.
Недостаточное содержание фтора в питьевой воде вызывает разрушение зубов – кариес.
Поэтому во многих местах, где содержание фтора ниже нормы, проводят искусственное фторирование воды, используют специальные зубные пасты.
Но и повышенное содержание фтора тоже вредно – это ведет к флюорозу, который выражается в появлении на зубах коричневых пятен, а в дальнейшем – к разрушению зубов.
Хлор
Основным источником поступления хлора в организм является поваренная соль (хлорид натрия).
Потребность человека в хлориде натрия 4-8 грамм в сутки.
Ионы хлора активизируют ферменты, создают благоприятную среду для действия ферментов желудочного сока.
Как я говорил ранее, соляная кислота входит в состав желудочного сока.
Изменение концентрации соляной кислоты в желудке приводит к гастриту.
Бром
В организме человека бром содержится в крови, почках, печени, но больше всего в головном мозге.
Бром регулирует нервную деятельность, усиливает процессы торможения в коре головного мозга.
Бромиды (соли бромоводородной кислоты HBr) обладают успокаивающим и противосудорожным действием, применяются при неврастении, неврозах, повышенной раздражимости, бессоннице.
Йод
В организме сосредоточен главным образом в щитовидной железе и входит в состав вырабатываемых ею гормонов.
Снижение содержания йода в щитовидной железе приводит к тяжелому заболеванию – эндемическому зобу, которое сопровождается нарушением обмена веществ.
Для предотвращения заболевания в поваренную соль добавляют йодат калия KIO3.
Дело в том, что в обычных продуктах питания йода обычно очень мало и поэтому его следует добавлять в пищу дополнительно.
Много йода содержится в морепродуктах. Морская вода – самый легкодоступный источник йода.
Применение
Химия прочно входит в нашу жизнь, внедряясь во все сферы. Человек научился применять галогены, а также его соединения на своё благо. Биологическое значение галогенов неоспоримо. Области применения их различны:
- медицина;
- фармакология;
- производство различных пластмасс, красителей и т. д.;
- сельское хозяйство.
Из природного соединение криолита, химическая формула которого выглядит следующим образом: Na3AlF6, получают алюминий. Соединения фтора нашли широкое распространение при производстве зубных паст. Фтор, как известно, служит для профилактики кариеса. Спиртовую настойку йода применяют для дезинфекции и обеззараживания ран.
Наиболее широкое применение в нашей жизни нашёл хлор. Область его применения довольно многообразна. Примеры использования:
- Производство пластмасс.
- Получение соляной кислоты.
- Производство синтетического волокна, растворителей, каучуков и др.
- Отбеливание тканей (льняных и хлопчатобумажных), бумаги.
- Обеззараживание питьевой воды. Но всё чаще для этой цели используется озон, так как применение хлора вредно для организма человека.
- Дезинфекция помещений
Нужно помнить, что галогены — очень токсичные вещества. Особенно ярко это свойство выражено у фтора. Галогены могут оказывать удушающее и воздействие на органы дыхания и поражать биологические ткани.
Огромную опасность могут иметь пары хлора, а также аэрозоль фтора, имеющий слабый запах, он может ощутиться при большой концентрации. Человек может получить эффект удушья. При работе с такими соединениями нужно соблюдать меры предосторожности.
Методы производства галогенов сложные и многообразные. В промышленности к этому подходят с определёнными требованиями, соблюдение которых неукоснительно соблюдаются.
Получение галогенов
В связи с тем, что в природных соединениях галогены имеют в основном отрицательную (—1) степень окисления, выделение их в свободном состоянии проводится путем окисления ионов галогенидов.
- Фтор получают из фторид-ионов только в процессе электролиза.
- Хлор получают из хлоридов путем электролиза растворов, содержащих ионы хлора, или путем воздействия на них сильными окислителями:
- Бром получают из бромидов путем электролиза растворов, содержащих бромид-ионы, или путем воздействия на них сильными окислителями. Кроме того, бром можно выделить воздействуя на растворы бромидов хлором, так как хлор — более сильный окислитель, чем бром:
- Йод выделяют из йодидов путем их электролиза или воздействия на них сильными окислителями, в частности, хлором и бромом
Получение хлора
Хлор получают в настоящее время в больших количествах путем электролиза водных растворов хлористых солей натрия или калия. Хлор выделяется у анода, а у катода образуется соответственно едкий натр или едкое кали. О получении хлора электролизом водного раствора хлористого натра.
Хлор в свободном состоянии можно получить при взаимодействии HCl и KClO3.
Интересные факты о галогенах: хлор считается микроэлементом, нехватка его в крови приводит к нарушении работы органов человека.
Недостаток хлорида натрия ведет к нарушению обмена веществ в организме, так как эта соль неотъемлемая часть жизнедеятельности всего организма.
В лабораториях хлор получают действием различных окислителей на соляную кислоту. Напомним, например, известный из школьного курса лабораторный способ получения хлора действием двуокиси марганца на соляную, кислоту:
В ионной форме эта реакция выразится уравнением:
из которого видно, что здесь происходит окисление ионов Сl’ в атомы хлора (образующие затем молекулы Сl2) и восстановление четырехвалентного марганца, входящего в состав МnO2, в двухвалентный (ионы Мn••). При помощи этой реакции хлор был впервые получен Шееле в 1774 г.
Аналогичным путем можно получить хлор из соляной кислоты, действуя на нее вместо МnO2 другими окислителями (например, РbO2, КClO3, КМnO4).
Кислород не взаимодействует при обычных условиях с НСl в сколько-нибудь заметной степени Но если пропускать смесь НСl и О2 через трубку, нагретую до 400° и содержащую кусочки пемзы, на которых распределена в качестве катализатора хлорная медь СuСl2, то происходив окисление хлористого водорода (ионов Сl—) кислородом:
4HCl + O2 ⇄ 2Cl2 + 2H2O
причем выход хлора достигает 80%. Этой реакцией раньше часто пользовались для получения хлора.
Получение брома и иода
Бром и иод могут быть получены аналогично хлору окислением НВr и HJ различными окислителями. В промышленном масштабе их обычно получают из бромистых или йодистых солей металлов, действуя на растворы последних хлором.
Таким образом, получение брома и иода тоже основано на окислении их ионов, только в качестве окислителя применяется хлор. Например:
2Br’ + Cl2 = 2Сl’ + Br2
2J’ + Сl2 = 2Сl’ + J2
В СНГ бром добывают из воды Сакского озера (в Крыму), содержащей довольно большое количество бромистых солей, и из «рапы» (насыщенного раствора) залива Кара-Богаз-Гол.
Освоено также получение брома из буровых вод.
Главным источником получения иода в СНГ служат воды буровых скважин. Для извлечения из этих вод иода к концу первой пятилетки были выстроены два больших завода в Сураханах и в Нефге-Чале, производительность которых вполне обеспечивает потребность нашей страны в иоде.
Получение фтора
Фтор, вследствие огромного сродства к электрону, может быть выделен из своих соединений исключительно электролитическим путем.
Впервые он был получен в 1886 г. путем разложения электрическим током безводного жидкого фтористого водорода HF, к которому было прибавлено около 20% фтористого калия KF.
Разложение производилось в приборе, выполненном из меди, на которую фтор не действует (после того, как медь покроется слоем фтористой меди). Электроды были сделаны из платины.
Метод, использованный для выделения элементарного фтора, осуществляется в настоящее время и при промышленном получении этого вещества.
Разложению электрическим током подвергают расплав состава KF • 2HF (темп. пл. 70° С). Электролиз ведут в стальных ваннах, пользуясь угольными электродами.
Галогеноводороды
Галогеноводоро́ды — общее название соединений, образованных из водорода и галогенов (элементов подгруппы фтора):
- Плавиковая кислота — водный раствор фтороводорода
- Соляная кислота — водный раствор хлороводорода
- Бромоводородная кислота — водный раствор бромоводорода
- Иодоводородная кислота — водный раствор иодоводорода
- Астатоводородная кислота — водный раствор астатоводорода
Все галогеноводороды — бесцветные ядовитые газы с резким запахом, хорошо растворимые в воде. На воздухе их концентрированные растворы дымят вследствие выделения галогеноводородов.
Сокращённо галогеноводороды обозначают НГ, а в источниках на языках, использующих латинский алфавит, — HHal.
| Фтороводород | HF | 20 | 91,7 | 1,86 | −270,7 | −83,4 | 19,5 | |
| Хлороводород | HCl | 36,5 | 127,4 | 1,11 | −92,3 | −114,2 | −85,1 | |
| Бромоводород | HBr | 81 | 141,4 | 0,79 | −36,3 | −86,9 | −66,8 | |
| Иодоводород | HI | 128 | 160,9 | 0,38 | 26,57 | −50,8 | −35,4 | |
| Астатоводород | HAt | 211 | 172,0 | -0,06 | −26,5 | −20,0 |
В ряду HCl — HBr — HI в соответствии с увеличением ковалентности связи уменьшается дипольный момент молекулы: соответственно 0,33 ⋅10−29, 0,26⋅10−29 и 0,19⋅10−29 Кл·м. В жидкой и газовой фазах молекулы HCl, HBr, HI, в отличие от HF, не ассоциированы. Прочность связи в ряду HCl — HBr — HI значительно уменьшается, поскольку уменьшается степень перекрывания взаимодействующих электронных облаков. Также уменьшается и их устойчивость к нагреванию.
В ряду HCl — HBr — HI закономерно изменяются температуры плавления и кипения, но при переходе к HF они резко возрастают. Это объясняется ассоциацией молекул фтороводорода в результате образования водородных связей.
Соединения галогенов с водородом
Из соединений галогенов наиболее важное практическое значение имеют галогеноводороды и соли галогеноводородов.
Химическая связь в молекулах галогеноводородов — полярная ковалентная: общая электронная пара смещена к атому галогена как более электроотрицательному. Некоторые свойства галогеноводородов приведены в табл. 24.
Прочность химической связи в молекулах галогеноводородов закономерно падает в ряду
: это проявляется в изменении энтальпии диссоциации молекул на атомы (табл. 24), Связь здесь ослабляется по тем же причинам, которые были рассмотрены при сопоставлении прочности молекул свободных галогенов (см. § 118). Как показывает схема (рис. 107), при переходе, например, от
к
уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду
электроотрицательность атома галогена уменьшается. Поэтому в молекуле
электронное облако атома водорода смещается в сторону атома галогена в наибольшей степени, а в молекулах
,
и
— все меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами.
С уменьшением прочности связи в молекулах галогеноводородов падает и их устойчивость к нагреванию. Термическая диссоциация фтороводорода происходит лишь при очень высоких температурах (более
), тогда как иодоводород уже при
в значительной степени распадается на иод и водород:
Все галогеноводороды — бесцветные газы с резким запахом.
Таблица 24. Некоторые свойства галогеноводородов
Галогеноводороды очень хорошо растворимы в воде. При
один объем воды растворяет около 500 объемов
, 600 объемов
и около 425 объемов
(при
); фтороводород смешивается с водой в любых соотношениях.
Растворение галогеноводородов сопровождается их диссоциацией по кислотному типу, причем только фтороводород диссоциирован сравнительно слабо, остальные же принадлежат к числу наиболее сильных кислот.
Рис. 107. Схема перекрывания электронных облаков при образовании молекул
и
. Пунктиром условно показано смещение электронного облака атома водорода а сторону атома галогена.
На воздухе концентрированные растворы галогеноводородов дымят вследствие выделения галогеноводородов, образующих о водяными парами воздуха туман, который состоит из мелких капелек соответствующих кислот.
В ряду
температуры кипения и плавления изменяются весьма закономерно (табл. 24), тогда как при переходе к
они резко возрастают. Как уже говорилось в § 47, это обусловлено ассоциацией молекул фтороводорода в результате возникновения между ними водородных связей. Как показывает определение плотности пара, вблизи температуры кипения газообразный фтороводород состоит из агрегатов, имеющих средний состав
. При дальнейшем нагревании эти агрегаты постепенно распадаются, причем лишь около
газообразный
состоит из простых молекул.
При растворении в воде молекулы фтороводорода диссоциируют с образованием ионов
и
. При этом частично разрываются водородные связи, так что диссоциация
на ионы требует значительной затраты энергии. Поэтому фтороводород диссоциирует в водных растворах в значительно меньшей степени, чем другие галогеноводороды, константа диссоциации фтороводорода равна
, так что по силе эта кислота лишь ненамного превосходит уксусную.
Образовавшиеся при диссоциации
ионы
в значительной степени связываются с недиссоциироваиными молекулами
, причем образуется ион
, в котором атомы фтора связаны друг с другом водородной связью:
Поэтому при нейтрализации фтороводорода сначала образуются кислые соли, например,
.
Отрицательные ионы галогеноводородов, за исключением фторид-иона, обладают восстановительными свойствами, возрастающими по ряду
.
Хлорид-ион окисляется фтором, перманганатом калия, диоксидом марганца и другими сильными окислителями, например:
Еще легче окисляются бромид- и, в особенности, иодид-ионы. Последние также легко окисляются бромом, нитратами, солями Fe (III), например:
Поскольку галогенид-ионы обладают восстановительными свойствами, то при действии галогеноводородов на металлы последние могут окисляться лишь ионами водорода
. Поэтому галогеноводороды могут реагировать в растворе только с металлами, стоящими в ряду напряжений до водорода.
Раствор фтороводорода в воде называется плавиковой кислотой. Это название происходит от плавикового шпата, из которого обычно получают фтороводород действием концентрированной серной кислоты:
Продажный раствор фтороводорода содержит обычно 40 %
. Фтороводород реагирует с большинством металлов. Однако во многих случаях образующаяся соль малорастворима, вследствие чего на поверхности металла образуется защитная пленка. Так ведет себя, в частности, свинец, что и позволяет использовать его для изготовления аппаратуры, устойчивой к действию
.
Соли фтороводорода называются фторидами. Большинство их малорастворимы в воде; хорошо растворимы лишь фториды
и
. Все соли плавиковой кислоты ядовиты.
Замечательным свойством фтороводорода и плавиковой кислоты является их способность взаимодействовать с диоксидом кремния
, входящим в состав стекла; в результате образуется газообразный фторид кремния
:
В растворе плавиковой кислоты выделения фторида кремния не происходит, так как он взаимодействует с молекулами
с образованием хорошо растворимой комплексной гексафторокремниевой (кремнефтороводородной) кислоты:
На взаимодействии
с диоксидом кремния основано применение плавиковой кислоты для вытравливания на стекле различных меток, надписей и рисунков.
Ввиду того, что фтороводород разрушает стекло, в лаборатории его хранят в сосудах из специальных сортов пластмасс. Его можно хранить также в сосудах из свинца или в стеклянных сосудах, покрытых изнутри слоем парафина.
Применение фтороводорода довольно разнообразно. Безводный HF используют, главным образом, при органических синтезах, а плавиковую кислоту — при получении фторидов, травлении стекла, удалении песка с металлических отливок, при анализах минералов.
Пары фтороводорода очень ядовиты. Попадая на кожу, концентрированная плавиковая кислота вызывает тяжелые ожоги.
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является синтез его из водорода и хлора:
Этот процесс осуществляют в специальных установках, в которых смесь водорода и хлора непрерывно образуется и тут же сгорает ровным пламенем. Тем самым достигается спокойное (без взрыва) протекание реакции. Исходным сырьем для получения хлороводорода служат хлор и водород, образующиеся при электролизе раствора
(§ 197).
Большие количества
получают также в качестве побочного продукта хлорирования органических соединений согласно схеме
где
— органический радикал.
Соляная кислота — бесцветная жидкость с резким запахом. Обычно концентрированная соляная кислота содержит около 37 % НС1, плотность ее 1,19 г/см3.
Прежний «сульфатный» метод получения
, применяемый в настоящее время только в лабораторной практике, основан на взаимодействии
и концентрированной
согласно уравнениям:
Первая из этих реакций протекает в значительной степени уже при слабом нагревании; вторая осуществляется лишь при более высоких температурах. В качестве побочного продукта получается сульфат натрия
.
При нагревании концентрированной соляной кислоты вначале улетучивается хлороводород с небольшим количеством воды. Это происходит до тех пор, пока в остатке не получится 20,2 %-ный раствор; последний перегоняется уже без изменения состава при постоянной температуре
. Наоборот, если нагревать разбавленную
, то отгоняется преимущественно вода. Когда концентрация
в остатке достигает 20,2 %, жидкость начинает перегоняться без изменения состава, как и в предыдущем случае. Подобные растворы, характеризующиеся одинаковым составом жидкости и насыщенного пара и поэтому перегоняющиеся без изменения состава, называются постоянно кипящими или азеотропными растворами.
Подобно другим сильным кислотам,
энергично взаимодействует со многими металлами и оксидами металлов. Соли ее называются хлоридами. Большинство их хорошо растворимы в воде. Малорастворимы
.
Соляная кислота — одна из важнейших кислот в химической практике. Ежегодное мировое производство соляной кислоты исчисляется миллионами тонн. Широкое применение находят также многие ее соли. Отметим важнейшие из хлоридов.
Хлорид натрия
или поваренная соль, служит сырьем для получения хлора, соляной кислоты, едкого натра и карбоната натрия (соды), применяется в красильном деле, в мыловарении и во многих других производствах. Он служит также приправой к пище и применяется в качестве средства, предохраняющего пищевые продукты от порчи.
Хлорид калия
в больших количествах потребляется сельским хозяйством в качестве удобрения.
Хлорид кальция
употребляется для приготовления охлаждающих смесей. Безводный
широко применяют в лабораторной практике для осушения газов и обезвоживания жидких органических веществ.
Хлорид ртути(II)
или сулема, очень сильный яд. Разбавленные растворы сулемы (1:1 ООО) используются в медицине как сильнодействующее дезинфицирующее средство (см. также стр. 607).
Хлорид серебра
— наименее растворимая соль соляной кислоты. Образование осадка
при взаимодействии ионов
с ионами
служит характерной реакцией на хлорид-ионы. Хлорид серебра применяют в фотографической промышленности при изготовлении светочувствительных материалов.
Бромоводород и иодоводород очень похожи по своим свойствам на хлороводород, но отличаются более выраженными восстановительными свойствами. Молекулярный кислород постепенно окисляет иодоводород уже при комнатной температуре, причем под действием света реакция сильно ускоряется:
Бромоводород взаимодействует с кислородом гораздо медленнее, в то время как при обычных условиях соляная кислота вовсе с ним не взаимодействует.
Восстановительные свойства бромоводорода и иодоводорода заметно проявляются и при взаимодействии с концентрированной серной кислотой. При этом
восстанавливает
до
:
a
— до свободной серы или даже до
:
или
Поэтому
трудно, a
практически невозможно получить действием серной кислоты на бромиды или иодиды. Обычно эти галогеноводороды получают действием воды на соединения брома и иода с фосфором —
и
. Последние подвергаются при этом полному гидролизу, образуя фосфористую кислоту и соответствующий галогеноводород:
Раствор иодоводорода (вплоть до 50%-ной концентрации)-можно получить, пропуская
в водную суспензию иода. Реакция идет согласно схеме:
Соли бромоводорода и иодоводорода называются соответственно бромидами и иодидами. Растворимость бромидов и иодидов в большинстве случаев подобна растворимости соответствующих хлоридов.
Растворы бромидов натрия и калия под химически неправильным названием «бром» применяются в медицине как успокаивающее средство при расстройствах нервной системы. Бромид серебра в больших количествах идет на изготовление фотоматериалов. И од ид калия применяют в медицине — в частности, при заболеваниях эндокринной системы.
Хлороводород, соляная кислота и их свойства
Среди галогенов особое значение имеет хлор и его производное – хлороводород HCl.
В лаборатории хлороводород обычно получают нагреванием твердого хлорида натрия с концентрированной серной кислотой:
Хлороводород HCl – это газ, который хорошо растворяется в воде, но не растворяется в концентрированной серной кислоте, поэтому улетучивается.
Из-за его хорошей растворимости в воде хлороводород нельзя собирать способом вытеснения воды, как, например, собирают водород или кислород.
Его собирают методом вытеснения воздуха, а чтобы он сам не попал в воздух, пробирку закрывают мокрой ватой.
Как видите, одно и то же свойство (хорошая растворимость в воде) может быть и вредным, и полезным – человек научился приручать химические вещества.
В промышленности хлороводород получают синтетическим путем, прямым соединением хлора с водородом:
Свойства хлороводорода HCl :
- бесцветный газ с резким запахом
- во влажном воздухе образует дым из-за физико-химической реакции с водой, он хорошо растворяется даже в мельчайших капельках влаги, которые не видны нашему глазу.
- этот газ ядовит, о чём кстати вам может сказать его резкий запах
Наше обоняние опознаёт токсичный газ и даёт нам об этом знать интенсивным нервным импульсом в мозг, который для нашего сознания преобразуется в резкий запах
Хлороводород относится к числу наиболее растворимых в воде газообразных веществ.
В 1 л воды при комнатной температуре может раствориться 500 л хлороводорода!
Раствор хлороводорода в воде называют соляной кислотой HCl.
Именно в виде раствора это вещество повсеместно применяется.
Концентрированная соляная кислота – бесцветный раствор, но чаще всего используемая соляная кислота бледно-желтая из-за примесей.
Соляную кислоту вы можете легко встретить в хозяйственных магазинах в отделе бытовой химии.
В быту её используют для смывания ржавчины и для прочистки засоров.
Дымит во влажном воздухе.
Максимальная концентрация соляной кислоты 40 %.
Соляная кислота имеет ряд общих свойств, характерных для неорганических кислот.
В ней растворяются многие металлы (кроме самых неактивных, таких как золото, платина, палладий).
Она так же, как и все кислоты, реагирует с основными и амфотерными оксидами, основаниями, солями (реакция идет только в тех случаях, если образуется осадок или газ).
Соли соляной кислоты называются хлоридами.
Они все растворимы в воде, за исключением хлорида серебра и хлорида свинца (II).
Кислородсодержащие соединения галогенов
Галогены образуют ряд соединений с кислородом. Однако все эти соединения неустойчивы, не получаются при непосредственном взаимодействии галогенов с кислородом и могут быть получены только косвенным путем. Такие особенности кислородных соединений галогенов согласуются с тем, что почти все они характеризуются положительными значениями стандартной энергии Гиббса образования (см., например, в табл. 7 на стр. 194 значения
для
и
).
Из кислородсодержащих соединений галогенов наиболее устойчивы соли кислородных кислот, наименее — оксиды и кислоты. Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительную степень окисленности, достигающую семи.
Фторид кислорода
можно получить пропусканием фтора в охлажденный 2 % раствор
. Реакция идет согласно уравнению:
Помимо
при этом всегда образуются кислород, озон и пер-оксид водорода. При обычных условиях
—бесцветный газ с резким запахом озона. Фторид кислорода очень ядовит, проявляет сильные окислительные свойства и может служить одним из эффективных окислителей ракетных топлив.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
Как уже указывалось, кислородные соединения хлора могут быть получены только косвенными методами. Рассмотрение путей их образования начнем с процесса гидролиза хлора, т. е. с обратимой реакции между хлором и водой
в результате которой образуются соляная кислота и хлорноватистая кислота
.
Гидролиз хлора является реакцией самоокисления-самовосстановления, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется.
Получающиеся при гидролизе хлора
и
могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается, когда прореагирует приблизительно
растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами
значительное количество соляной и хлорноватистой кислот.
Хлорноватистая кислота
— очень слабая кислота (
), более слабая, чем угольная; соли ее называются гипохлоритами. Будучи весьма нестойким соединением, хлорноватистая кислота даже в разбавленном растворе постепенно распадается (см. ниже).
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие в системе
сдвигается вправо; реакция практически доходит до конца и получается раствор, содержащий соли хлорноватистой и соляной кислот:
Тот же результат получится, если непосредственно пропускать хлор в холодный раствор щелочи
или в ионно-молекулярной форме:
Полученный таким путем раствор солей хлорноватистой и соляной кислот применяется для беления; его белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже при действии диоксида углерода, находящегося в воздухе,
причем образуется хлорноватистая кислота:
Последняя и обесцвечивает красящие вещества, окисляя их.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор гидроксида натрия. Оба раствора можно получить электролизом растворов хлоридов калия или натрия, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами (см, стр. 549).
При действии хлора на сухую гашеную известь получается так называемая белильная, или хлорная известь. Главной ее составной частью является соль
, образующаяся согласно уравнению:
Этой соли отвечает структурная формула
, согласно которой
следует рассматривать как смешанную соль соляной и хлорноватистой кислот.
Хлорная известь представляет собой белый порошок с резким запахом и обладает сильными окислительными свойствами. Во влажном воздухе под действием диоксида углерода она постепенно разлагается, выделяя хлорноватистую кислоту:
При действии на хлорную известь соляной кислоты выделяется хлор:
Хлорная известь применяется для отбелки растительного волокна (тканей, бумаги) и для дезинфекции.
В растворе хлорноватистая кислота испытывает три различных типа превращений, которые протекают независимо друг от друга:
Изменяя условия, можно добиться того, что реакция пройдет практически нацело по какому-нибудь одному направлению.
Под действием прямого солнечного света и в присутствии некоторых катализаторов или восстановителей разложение хлорноватистой кислоты протекает согласно уравнению (I).
Реакция (2) идет в присутствии водоотнимающих средств, например
, В результате реакции получается оксид хлора(I) (хлорноватистый ангидрид)
, представляющий собой крайне неустойчивый желто-бурый газ с запахом, похожим на запах хлора.
Распад
согласно реакции (3) особенно легко идет при нагревании. Поэтому, если пропускать хлор в горячий раствор гидроксида калия, то вместо
сразу получается
:
Продуктами реакции являются хлорид калия и хлорит калия
— соль хлорноватой кислоты
. Поскольку хлорат калия (или бертолетова соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
Соответствующая хлоратам хлорноватая кислота известна только в виде водного раствора с концентрацией не выше 50%. Она проявляет свойства сильной кислоты (приблизительно равной по силе
и
) и сильного окислителя. Так, концентрированные ее растворы воспламеняют дерево.
В противоположность свободной
, у хлоратов окислительные свойства в растворе выражены слабо. Большинство из них хорошо растворимы в воде; все они ядовиты. Наибольшее применение из хлоратов находит
, который при нагревании легко разлагается. В присутствии
(в качестве катализатора) разложение в основном протекает согласно уравнению:
С различными горючими веществами (серой, углем, фосфором)
образует смеси, взрывающиеся при ударе. На этом основано его применение в артиллерийском деле для устройства запалов. Хлорат калия употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главный же потребитель хлората калия — спичечная промышленность. В головке обычной спички содержится около 50 %
.
Ангидрид хлорноватой кислоты неизвестен. При действии концентрированней серной кислоты на
вместо него выделяется желто-бурый газ с характерным запахом — диоксид (или двуокись) хлора
. Это очень неустойчивое соединение, которое при нагревании, ударе или соприкосновении с горючими веществами легко разлагается со взрывом на .хлор н кислород.
Диоксид хлора применяют для отбелки или стерилизации различных материалов (бумажной массы, муки и др.).
При взаимодействии
с раствором щелочи медленно протекает реакция
с образованием солен двух кислот — хлорноватой
и хлористой
.
Хлористая кислота мало устойчива. По силе и окислительной активности она занимает промежуточное положение между
и
. Соли ее — хлориты используются при отбелке тканей.
При осторожном нагревании хлората калия без катализатора его разложение протекает в основном согласно схеме:
Образующийся перхлорат калия
очень мало растворим в воде и поэтому может быть легко выделен.
Действием концентрированной серной кислоты на
может быть получена свободная хлорная кислота
, представляющая собой бесцветную, дымящую на воздухе жидкость.
Безводная
малоустойчива и иногда взрывается при храпении, но ее водные растворы вполне устойчивы. Окислительные свойства
выражены слабее, чем у
, а кислотные свойства— сильнее. Хлорная кислота — самая сильная из всех известных кислот.
Соли
, за немногими исключениями, к которым относится и
, хорошо растворимы и в растворе окислительных свойств не проявляют.
Если нагревать хлорную кислоту с
, отнимающим от нее воду, то образуется оксид хлора(VII), или хлорный ангидрид,
Оксид хлора (VII)—маслянистая жидкость, кипящая с разложением при
. При ударе или при сильном нагревании
взрывается.
Изменение свойств в ряду кислородных кислот хлора можно выразить следующей схемой:
С увеличением степени окисленности хлора устойчивость его кислородных кислот растет, а их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота.
Напротив, сила кислородных кислот хлора возрастает с увеличением его степени окисленности. Из всех гидроксидов хлора самая слабая кислота — хлорноватистая, самая сильная — хлорная. Такая закономерность — усиление кислотных свойств гидроксида (и, соответственно, ослабление его основных свойств) с ростом степени окисленности элемента характерна не только для хлора, но и для других элементов. В первом приближении эту закономерность можно объяснить, рассматривая все химические связи в молекулах гидроксидов как чисто ионные.
На рис. 108 схематически изображена часть молекулы гидроксида
, составленная из
-зарядного иона
, иона кислорода
и иона водорода (протона)
. Диссоциация этой части молекулы на ионы может происходить либо с разрывом связи
(в результате чего отщепляется ион
), либо с разрывом связи
(что приводит к отщеплению иона
); в первом случае гидроксид будет проявлять свойства основания, во втором— свойства кислоты.
Рис. 108. Ионная схема фрагмента молекулы гидроксида
Каждый из возможных путей диссоциации гидроксида будет осуществляться тем легче, чем слабее связь между соответствующими ионами. При возрастании степени окисленности элемента
увеличится заряд иона
, что усилит его притяжение к иону
и тем самым затруднит диссоциацию гидроксида по типу основания. Вместе с тем усилится взаимное отталкивание одноименно заряженных ионов
и
, что облегчит диссоциацию по кислотному типу. Таким образом, с увеличением степени окисленности элемента усиливаются кислотные свойства и ослабевают основные свойства образуемого этим элементом гидроксида.
Увеличение радиуса иона
при неизменном его заряде приведет к возрастанию расстояний между центром этого иона и центрами ионов
и
. В результате взапмиое электростатическое притяжение ионов
и
станет более слабым, что облегчит диссоциацию по основному типу; одновременно уменьшится взаимное отталкивание ионов
и
, так что диссоциация по кислотному типу затруднится. Следовательно, с возрастанием радиуса иона элемента (при неизменном его заряде) усиливаются основные свойства и ослабляются кислотные свойства образуемого этим элементом гидроксида. Примером проявления этой закономерности может служить изменение констант кислотной диссоциации в ряду
.
Разумеется, предположение о чисто ионной природе химических связей в молекулах гидроксидов является весьма грубым. В действительности связь
имеет преимущественно ковалентный характер, а связь
можно считать близкой к ионной только для щелочных металлов. Кроме того, изложенная трактовка кислотно-основных свойств гидроксидов не учитывает особенностей взаимодействия ионов
и
с молекулами растворителя (воды). Поэтому рассмотренная схема влияния заряда и размеров иона
на характер диссоциации молекулы
не может служить основой для количественной оценкн кислотно-основных свойств гидроксидов. Однако при сопоставлении кислотно-основных свойств различных гидроксидов, образуемых данным элементом в разных состояниях его окисленности, или при сопоставлении свойств аналогичных гидроксидов, образуемых элементами одной и той же подгруппы периодической системы, эта схема в большинстве случаев приводит к правильным качественным выводам.
Кислородные соединения брома и иода
Растворы бромноватистой
и иодноватистой
кислот могут быть получены, подобно хлорноватистой кислоте, взаимодействием соответствующих галогенов с водой
причем в ряду
равновесие все в большей степени смещается влево.
При переходе от
к
и
устойчивость и окислительная активность кислот уменьшаются. По этому же ряду ослабляются и кислотные свойства (см. выше). Иодноватистая кислота
является уже амфотерным соединением, у которого основные свойства несколько преобладают над кислотными.
Бромноватую
и йодноватую
кислоты можно получить путем окисления бромной или йодной воды хлором:
Бромноватая кислота очень похожа по свойствам на
, а окислительные и кислотные свойства
выражены значительно слабее.
Йодноватая кислота представляет собой бесцветные кристаллы, вполне устойчивые при комнатной температуре. При осторожном нагревании ее до
можно получить порошок оксида иoдa(V), или йодноватого ангидрида —
:
Йодноватый ангидрид проявляет окислительные свойства, а при нагревании выше
распадается на иод и кислород.
До недавнего времени считали, что бром не образует соединений, в которых его степень окнсленности равна семи. Однако в 1968 г. путем окисления
были получены перброматы и соответствующая им бромная кислота
. Наилучшим окислителем оказался
:
О свойствах бромной кислоты и ее солей пока известно мало. Напротив, йодная кислота
и ее соли (периодаты) хорошо изучены.
Сама кислота может быть получена действием иода на
или электролизом раствора
:
Из раствора йодная кислота выделяется в виде бесцветных кристаллов, имеющих состав
. Этот гидрат следует рассматривать как пятиосновную кислоту
(ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например,
). Йодная кислота — слабая, но более сильный окислитель, чем
.
Оксид иода (VII)
не получен.
Примеры реакций галогенов с металлами
2Fe + 3Сl2 = 2FeCl3
Сu + Сl2 = СuСl2
Здесь железо в реакции с хлором проявляет степень окисления, равную +3 — Fe+3, а медь равную +2— Cu+2. Во всех приведенных случаях хлор ведет себя как окислитель .
Бурно реагирует с металлами и бром. Если насыпать в пробирку с жидким бромом немного алюминиевых опилок, то они сгорают в броме с образованием бромистого алюминия, что сопровождается выделением бурых паров брома и снопом искр. Реакция идет по следующему уравнению:
2Аl + ЗВr2 = 2АlВr3
Опыт производится в приборе, изображенном на рис. 24. Длинная трубка 1 выполняет роль воздушного холодильника. Горят в броме также олово, сурьма, а калий с бромом дает сильный взрыв.
Рис. 22. Самовоспламенение сурьмы в хлоре
Иод также реагирует с металлами, образуя йодистые соли. Особенно интересно происходит реакция алюминия с иодом. Для этого кристаллы иода растирают в ступке до образования мелкого порошка, а затем на асбестированной сетке смешивают иод с алюминиевой пылью.
Смесь, посуда и материалы должны быть совершенно сухими. Если после этого добавить к смеси каплю воды, которая является катализатором в этом процессе, то смесь воспламеняется и горит, выделяя фиолетовые клубы паров иода
2Аl + 3I2 = 2АlI3
Следует отметить, что иод реагирует с металлами труднее, чем хлор и бром.
В отличие от большинства других простых веществ галогены в непосредственное взаимодействие с кислородом не вступают, так как кислород и галогены обладают близкими значениями электроотрицательности. Вместе с тем кислородные соединения галогенов косвенным путем получены и существуют.
1- металлический натрий
2- хлоркальциевая трубка
3- хлор
4- едкий калий
- Докажите путем составления электронного баланса, что в реакциях с водородом и металлами галогены ведут себя как окислители. Обоснуйте такое поведение строением атома галогенов.
- Какой объем хлористого водорода может быть получен при реакции с водородом 20 л хлора? (эта задача решается целиком в объемах).
- 16. Для того чтобы образующийся хлористый водород не был загрязнен хлором, при взаимодействии хлора с водородом последнего берут на 5% больше требуемого количества. Рассчитайте, какой объем водорода следует взять для получения 50 л хлористого водорода. (См. Ответ)
Примеры решения задая
ПРИМЕР 1
| Задание | Составьте уравнения следующих реакций: 1) FеSО4 + КClO3 + Н2SО4 → … 2) FеSО4 + КClO3 + КОН → … 3) I2 + Ва(ОН)2 → … 4) КВr + КВrО3 + Н2SО4 → … |
| Ответ | а) В этой реакции железо повышает степень окисления с «+2» до «+3», т.е. FеSО4 является восстановителем, а хлор понижает степень окисления с «+5» до «1» , т.е. КClO3 является окислителем: 6FеSО4 + КClO3 + 3Н2SО4 = 3Fе2(SО4)3 + КСl + 3Н2О б) В этой реакции железо повышает степень окисления с «+2» до «+3», т.е. FеSО4 является восстановителем, а хлор понижает степень окисления с «+5» до «1» , т.е. КClO3 является окислителем: 6FеSО4 + КClO3 + 12КОН + 3Н2О = 6Fе(ОН)3↓ + КСl + 6К2SO4 в) В этой реакции йод и повышает, и понижает степень окисления с «0» до «+5» и с «0» до «-1», т.е. I2 является и восстановителем, и окислителем – происходит реакция диспропорционирования: 6I2 + 6Ва(ОН)2 = 5ВаI2 + Ва(IO3)2 + 6Н2О г) В этой реакции бром и повышает, и понижает степень окисления с «-1» до «0» и с «+5» до «0», т.е. КВr является восстановителем, а КВrО3 – окислителем: 5КВr + КВrО3 + 3Н2SО4 = 3Вr2 + 3К2SО4 + 3Н2О |
ПРИМЕР 2
| Задание | Какое количество алюминия потребуется для реакции с соляной кислотой, взятой в избытке, чтобы получить 5,6 л водорода (н.у.)? |
| Решение | Запишем уравнение реакции: 2Al + 6HCl = 2AlCl3 + 3H2↑ По уравнению количество вещества алюминия – 1 моль, а водорода – 3 моль. Тогда объем водорода, рассчитанный по уравнению: V(H2)=v(H2)×Vm=3×22,4 = 67,2 л Составим пропорцию: 2 моль Al — 67,2 л H2 х моль Al — 5,6 л H2 х=2×5,6/67,2=0,17 v(Al)=0,17 моль |
| Ответ | Количество вещества алюминия 0,17 моль |