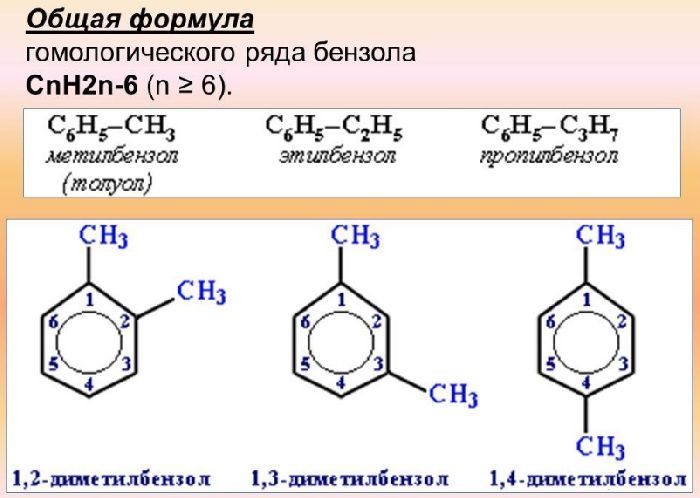
Что такое бензол
это органическое вещество, прозрачная жидкость со сладковатым запахом. по химической структуре относится к простейшим ароматическим углеводородам.
основные естественные источники бензола в природе — каменный уголь и нефть. в лабораторных условиях возможна его полимеризация (образование) из ацетилена. промышленные способы получения бензола — коксование из каменного угля, а также каталитический риформинг и пиролиз бензиновых фракций нефти.
химическая формула бензола — c6h6. это циклическая структура из шести атомов углерода была открыта в 1865 году немецким химиком фридрихом августом кекуле. а впервые в чистом виде бензол был обнаружен ещё раньше — в 1825 г. английский физик фарадей выделил его светильного газа.

физические свойства бензола включают плохую растворимость в воде, смешиваемость с органическими растворителями, высокую степень воспламеняемости, горючесть, взрывоопасность. его расплавление происходит при температуре 5,5–6,0 °c, испарение при 79,6–80,5 °c, кипение — 80,1 °c. он легче воды, так как имеет низкую относительную плотность (0,88 г/см3). является легкорастворимым в эфире и спирте веществом.
химические свойства бензола обусловлены его принадлежностью к группе ненасыщенных углеводородов с циклической структурой. поэтому ему типичны реакции окисления и замещения. методика промышленной разработки была предложена немецким учёным гофманом, выделившим вещество из каменноугольной смолы.
бензол сильно ядовит. токсическое действие происходит:
- ингаляционно — при вдыхании паров;
- трансдермально — при непосредственном контакте с кожей или слизистыми оболочками;
- перорально — при ошибочном употреблении жидкости внутрь.
многие интересные факты о бензоле, связанные с изучением его структуры и свойств, сохранились и дошли до наших дней. так, немецкий учёный гофман, читая лекции студентам о физических свойствах углеводородов, всегда цитировал слова знакомой ему дамы, что запах бензола такой же, как у стираных перчаток. а идея кольцевой структуры бензола якобы пришла к химику кекуле во сне — змея, состоящая из шести атомов углерода, свернулась в кольцо и укусила себя за хвост.
История
впервые бензолсодержащие смеси, образующиеся в результате перегонки каменноугольной смолы, описал немецкий химик иоганн глаубер в книге furni novi philosophici, опубликованной в 1651 году. бензол как индивидуальное вещество был описан майклом фарадеем, выделившим это вещество в 1825 году из конденсата светильного газа, получаемого коксованием угля. вскоре, в 1833 году, получил бензол — при сухой перегонке кальциевой соли бензойной кислоты — и немецкий физико-химик эйльгард мичерлих. именно после этого получения вещество стали называть бензолом.
к 1860-м годам было известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и эмпирическая формула их — c nhn. изучением бензола серьёзно занялся немецкий химик фридрих август кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения. известна история о том, что ф. кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода . идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. фридриху кекуле удалось в то время наиболее полно описать свойства бензола.
Физические свойства

бесцветная жидкость со своеобразным резким запахом. температура плавления = 5,5 °c, температура кипения = 80,1 °c, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. с воздухом образует взрывоопасные смеси, хорошо смешивается с эфиром, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25 °c (91 % бензола). растворимость в воде 1,79 г/л (при 25 °c).
Химические свойства
для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
- взаимодействие с алкенами (алкилирование), в результате реакции образуются гомологи бензола, например, этилбензол и кумол:
c6h6 + h2c = ch2 →alcl3∗hcl c6h5ch2ch3c6h6 + ch2 = ch − ch3 →alcl3 ∗ hcl c6h5ch(ch3)2
- взаимодействие с хлором и бромом в присутствии катализатора с образованием хлорбензола (реакция электрофильного замещения):
c6h6 + cl2 →fecl3 c6h5cl + hcl
- в отсутствие катализатора при нагревании или освещении идёт радикальная реакция присоединения с образованием смеси изомеров гексахлорциклогексана
c6h6 + 3cl2 →t,hν c6h6cl6
- при взаимодействии бензола с бромом в растворе олеума образуется гексабромбензол:
c6h6 + 6br2 →h2so4 ∗ so3 c6br6 + 6hbr
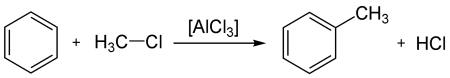
- взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция фриделя — крафтса) с образованием алкилбензолов:
- реакция ацилирования по фриделю—крафтсу, бензола ангидридами, галогенангидридами карбоновых кислот приводит к образованию ароматических и жирноароматических кетонов:
c6h6 + (ch3co)2o →alcl3 c6h5coch3 + ch3cooh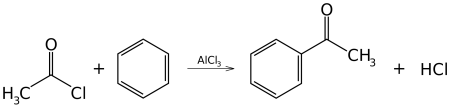
c6h6 + c6h5cocl →alcl3 c6h5coc6h5 + hcl
в первой и второй реакциях образуется ацетофенон (метилфенилкетон), замена хлорида алюминия на хлорид сурьмы v позволяет снизить температуру протекании реакции до 25° с. в третьей реакции образуется бензофенон (дифенилкетон).
- реакция формилирования — взаимодействие бензола со смесью со и нсl, протекает при высоком давлении и под действием катализатора, продуктом реакции является бензальдегид:
c6h6 + co + hcl →alcl3 c6h5coh + hcl
- реакции сульфирования и нитрования (электрофильное замещение):
c6h6 + hno3 →h2so4 c6h5no2 + h2oc6h6 + h2so4 → c6h5so3h + h2o
- восстановление бензола водородом (каталитическое гидрирование):
c6h6 + 3h2 →ni/pd,pt;t c6h12
Реакции окисления
бензол, вследствие своего строения, очень устойчив к окислению, на него не действует, например, раствор перманганата калия. однако окисление до малеинового ангидрида можно провести при помощи катализатора оксида ванадия v:

- реакция озонолиза. также бензол подвергается озонолизу, но процесс протекает медленнее, чем с непредельными углеводородами:
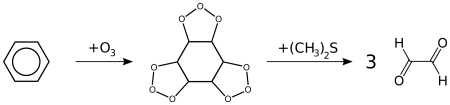
результатом реакции является образование диальдегида — глиоксаля (1,2-этандиаля).
- реакция горения. горение бензола является предельным случаем окисления. бензол легко воспламеняется и горит на воздухе сильно коптящим пламенем:
2c6h6 + 15o2 → 12co2 + 6h2o
Биологическое действие и токсикология
бензол является одним из самых распространённых ксенобиотиков антропогенного происхождения.
бензол сильно ядовит. минимальная летальная доза при пероральном приеме составляет 15 мл, средняя 50-70 мл. при непродолжительном вдыхании паров бензола не возникает немедленного отравления, поэтому до недавнего времени порядок работ с бензолом особо не регламентировался. в больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. первым признаком отравления бензолом нередко бывает эйфория. пары бензола могут проникать через неповрежденную кожу. жидкий бензол довольно сильно раздражает кожу. если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными.
бензол является сильным канцерогеном. исследования показывают связь бензола с такими заболеваниями, как апластическая анемия, острые лейкозы (миелоидный, лимфобластный), хронический миелоидный лейкоз, миелодиспластический синдром и заболевания костного мозга.
Механизм трансформации и мутагенное воздействие бензола
существует несколько вариантов механизма трансформации бензола в организме человека. в первом варианте происходит гидроксилирование молекулы бензола микросомальной системой окисления при участии цитохрома p450. согласно механизму, бензол окисляется сначала до высокореакционного эпоксида, который далее преобразуется в фенол. помимо этого происходит генерация свободных радикалов (активные формы кислорода), вследствие высокой активации р450 по реакции:
цит р450 + nadph + h- + o2→ цит р450 + nadp+ + hooh.
hooh → 2оh·
c6h6 + оh·→c6h5oh
биотрансформация бензола, механизм i. цифрами обозначены: 1 бензол, 2 бензолоксид, 3 эпоксибензол, 4 фенол, 5 пирокатехин, 6 гидрохинон.
Бензол и токсикомания
бензол оказывает на человека одурманивающее воздействие и может приводить к наркотической зависимости.
Острое отравление
при очень высоких концентрациях — почти мгновенная потеря сознания и смерть в течение нескольких минут. окраска лица синюшная, слизистые оболочки часто вишнёво-красные. при меньших концентрациях — возбуждение, подобное алкогольному, затем сонливость, общая слабость, головокружение, тошнота, рвота, головная боль, потеря сознания. наблюдаются также мышечные подёргивания, которые могут переходить в тонические судороги. зрачки часто расширены, не реагируют на свет. дыхание сначала учащено, затем замедлено. температура тела резко снижается. пульс учащенный, малого наполнения. кровяное давление понижено. известны случаи сильной сердечной аритмии.
после тяжёлых отравлений, которые не приводят непосредственно к смерти, иногда наблюдаются длительные расстройства здоровья: плевриты, катары верхних дыхательных путей, заболевания роговицы и сетчатки, поражения печени, сердечные расстройства и т. д. описан случай вазомоторного невроза с отёком лица и конечностей, расстройствами чувствительности и судорогами через короткое время после острого отравления парами бензола. иногда смерть наступает спустя некоторое время после отравления.
Хроническое отравление
в тяжёлых случаях наблюдаются: головные боли, чрезвычайная утомляемость, одышка, головокружение, слабость, нервность, сонливость или бессонница, расстройство пищеварения, тошнота, иногда рвота, отсутствие аппетита, учащение мочеиспускания, менструаций, нередко развиваются упорные кровотечения из слизистой оболочки рта, особенно дёсен, и носа, длящиеся часами и даже сутками. иногда упорные кровотечения наблюдаются после удаления зуба. многочисленные мелкие геморрагии (кровоизлияния) в коже.
кровь в испражнениях, маточные кровотечения, кровоизлияния в сетчатку. обычно именно кровотечения, а часто и сопутствующая им лихорадка (температура до 40° и выше) приводят отравленных в больницу. в подобных случаях прогноз всегда серьёзен. причиной смерти иногда являются вторичные инфекции: известны случаи гангренозного воспаления надкостницы и некроза челюсти, тяжёлых язвенных воспалений дёсен, общего сепсиса с септическим эндометритом.
иногда при тяжёлых отравлениях развиваются симптомы нервных заболеваний: повышение сухожильных рефлексов, двусторонний клонус, положительный симптом бабинского, расстройство глубокой чувствительности, псевдотабетические расстройства с парестезиями, атаксией, параплегией и двигательными нарушениями (признаки поражения задних столбов спинного мозга и пирамидных путей).
наиболее типичны изменения крови. число эритроцитов обычно резко снижено, вплоть до 1—2 млн и ниже. содержание гемоглобина также сильно падает, иногда до 10 %. цветной показатель в части случаев низок, иногда близок к нормальному, а порой высок (особенно при сильной анемии). отмечают анизоцитоз и пойкилоцитоз, базофильную пунктацию и появление ядерных эритроцитов, увеличение числа ретикулоцитов и объёма эритроцитов. типичнее резкое уменьшение числа лейкоцитов.
иногда первоначально лейкоцитоз, быстро сменяющийся лейкопенией, ускорение соэ. изменения со стороны крови развиваются не одновременно. чаще всего раньше поражается лейкопоэтическая система, позже присоединяется тромбоцитопения. поражение эритробластической функции часто наступает ещё позже. в дальнейшем может развиться характерная картина тяжёлого отравления — апластическая анемия.
явления отравления могут сохраняться и даже прогрессировать через месяцы и годы после прекращения работы с бензолом.
Структура
бензол по составу относится к ненасыщенным углеводородам (гомологический ряд cnh2n−6), но в отличие от углеводородов ряда этилена, c2h4, проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения), только при жёстких условиях, а вот к реакциям замещения бензол более склонен. такое «поведение» бензола объясняется его особым строением: нахождением атомов в одной плоскости и наличием в структуре сопряжённого 6π-электронного облака.
современное представление об электронной природе связей в бензоле основывается на гипотезе лайнуса полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
в специальной и популярной литературе распространён термин бензольное кольцо, относящийся, как правило, к углеродной структуре бензола без учёта иных атомов и групп, связанных с атомами углерода. бензольное кольцо входит в состав множества различных соединений.
Производство
на сегодняшний день существует несколько принципиально различных способов производства бензола.
- коксование каменного угля. этот процесс исторически был первым и служил основным источником бензола до второй мировой войны. в настоящее время доля бензола, получаемого этим способом, составляет менее 10 %. следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
- каталитический риформинг (аромаизинг) бензиновых фракций нефти. этот процесс является основным источником бензола в сша. в западной европе, россии и японии этим способом получают 40—60 % от общего количества вещества. в данном процессе кроме бензола образуются толуол и ксилолы. ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол — методом гидродеалкилирования;
- смесь бензола и ксилолов — методом диспропорционирования.
- пиролиз бензиновых и более тяжёлых нефтяных фракций. до 50 % бензола производится этим методом. наряду с бензолом образуются толуол и ксилолы. в некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
- получение бензола методом реппе тримеризация ацетилена — при пропускании ацетилена при 400 °c над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3с2н2 → с6h6. получение бензола из ацетилена связывают с именем марселена бертло, работы которого были начаты в 1851 году. однако продуктом реакции по методу бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. лишь в 1948 году в. реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции. полностью механизм реакции был описан только в 2020 году сотрудниками института органической химии им. н. д. зелинского ран .
Применение
значительную часть получаемого бензола используют для синтеза других продуктов:
- около 50 % бензола превращают в этилбензол (алкилирование бензола этиленом);
- около 25 % бензола превращают в кумол (алкилирование бензола пропиленом);
- приблизительно 10—15 % бензола гидрируют в циклогексан;
- около 10 % бензола расходуют на производство нитробензола;
- 2—3 % бензола превращают в линейные алкилбензолы;
- приблизительно 1 % бензола используется для синтеза хлорбензола.
в существенно меньших количествах бензол используют для синтеза некоторых других соединений. изредка и в крайних случаях, ввиду высокой токсичности, бензол используют в качестве растворителя.
кроме того, бензол входит в состав бензина. в 1920-х — 1930-х годах, бензол добавлялиrude в прямогонный бензин для повышения его октанового числа, но к 1940-м годам такие смеси не выдержали конкуренции с высокооктановыми бензинами. ввиду высокой токсичности содержание бензола в топливе ограничено современными стандартами введением до 1 %.
Примеры решения задач
пример 1
| задание | запишите уравнения, с помощью которых можно осуществить следующие превращения: ch4 → c2h2 → c6h6 → c6h5cl. |
| решение | для получения ацетилена из метана используют следующую реакцию: 2ch4 → c2h2 + 3н2↑ (t получение бензола из ацетилена возможно по реакции тримеризации ацетилена, протекающей при нагревании (t 3c2h2 → c6h6. реакция хлорирования бензола с получением в качестве продукта хлорбензола осуществляется в присутствии хлорида железа (iii): c6h6 + cl2 → c6h5cl + hcl. |
пример 2
| задание | к 39 г бензола в присутствии хлорида железа (iii) добавили 1 моль бромной воды. какое количество вещества и сколько граммов каких продуктов при этом получилось? |
| решение | запишем уравнение реакции бромирования бензола в присутствии хлорида железа (iii): c6h6 + br2 → c6h5br + hbr. продуктами реакции являются бромбензол и бромоводород. молярная масса бензола, рассчитанная с использованием таблицы химических элементов д.и. менделеева – 78 г/моль. найдем количество вещества бензола: n(c6h6) = m(c6h6) / m(c6h6); n(c6h6) = 39 / 78 = 0,5 моль. по условию задачи бензол вступил в реакцию с 1 моль брома. следовательно, бензол находится в недостатке и дальнейшие расчеты будем производить по бензолу. согласно уравнению реакции n(c6h6): n(c6h5br) : n(hbr) = 1:1:1, следовательно n(c6h6) = n(c6h5br) = : n(hbr) = 0,5 моль. тогда, массы бромбензола и бромоводорода будут равны: m(c6h5br) = n(c6h5br)×m(c6h5br); m(hbr) = n(hbr)×m(hbr). молярные массы бромбензола и бромоводорода, рассчитанные с использованием таблицы химических элементов д.и. менделеева – 157 и 81 г/моль, соответственно. m(c6h5br) = 0,5×157 = 78,5 г; m(hbr) = 0,5×81 = 40,5 г. |
| ответ | продуктами реакции являются бромбензол и бромоводород. массы бромбензола и бромоводорода – 78,5 и 40,5 г, соответственно. |