- Что такое водород
- История открытия
- Место в таблице Менделеева
- Строение молекулы
- Нахождение в природе, изучение его свойств
- Химические и физические свойства
- Электронная схема водорода
- Степень окисления водорода
- Соединения водорода
- Вычисление водорода
- Вычисление объема газов по уравнениям химических реакций
- Способы получения водорода
- Электролиз воды
- Получение водорода концентрированием
- Конденсация под действием низких температур
- Способ адсорбции
- Добыча водорода в условиях домашнего хозяйства
- Практическое применение
- Существующие установки
Что такое водород
Водород — самый легкий химический элемент, занимающий в периодической таблице Менделеева начальное место.
Его атомный номер — единица. На одноатомную форму водорода приходится около 75% барионной массы, она считается самым распространенным веществом во всей Вселенной. Водородная плазма — основное вещество звезд, за исключением компактных.

У водорода три изотопа:
- протий (1H);
- дейтерий (2H);
- тритий (3H).
К общим характеристикам относятся следующие свойства: не имеет цвета запаха, вкуса. Двухатомная форма (Н2) нетоксична, однако в соединении с воздухом (или О2) пожароопасна и склонна к взрывам. Взрывоопасность также проявляется в присутствии прочих газов-окислителей, например, фтора, хлора.
На Земле водород присутствует в составе молекулярных соединений, например, вода. Его роль в кислотно-основных реакциях трудно переоценить.
История открытия
Первым среди ученых водород заметил еще великий алхимик и лекарь средневековья Теофраст Парацельс. В своих алхимических опытах, в надежде отыскать «философский камень» смешивая металлы с кислотами Парацельс получил некий неизвестный до того горючий газ. Правда отделить этот газ от воздуха так и не удалось.
Только спустя полтора века после Парацельса французскому химику Лемери таки удалось отделить водород от воздуха и доказать его горючесть. Правда Лемери так и не понял, что полученный им газ является чистым водородом. Параллельно подобными химическими опытами занимался и русский ученый Ломоносов, но настоящий прорыв в исследовании водорода был сделан английским химиком Генри Кавендишом, которого по праву считают первооткрывателем водорода.
В 1766 году Кавендишу удалось получить чистый водород, который он называл «горючим воздухом». Еще через 20 лет талантливый французский химик Антуан Лавуазье смог синтезировать воду и выделить из нее этот самый «горючий воздух» – водород. И к слову именно Лавуазье предложил водороду его название – «Hydrogenium», он же «водород».
Антуан Лавуазье со своей женой, помогавшей ему проводить химические опыты, в том числе и по синтезу водорода.
Место в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. То есть иными словами водород и его атомный вес является краеугольным камнем таблицы Менделеева, той точкой опоры, на основе которой великий химик создал свою систему. Поэтому не удивительно, что в таблице Менделеева водород занимает почетное первое место.
Помимо этого водород имеет такие характеристики:
- Атомная масса водорода составляет 1,00795.
- У водорода в наличии три изотопа, каждый из которых обладает индивидуальными свойствами.
- Водород – легкий элемент имеющий малую плотность.
- Водород обладает восстановительными и окислительными свойствами.
- Вступая в химические реакции с металлами, водород принимает их электрон и стает окислителем. Подобные соединения называются гидратами.

Строение молекулы
Водород это газ, молекула его состоит из двух атомов.
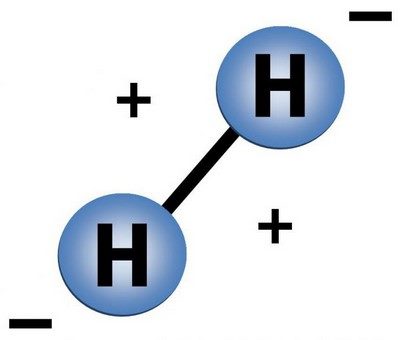
Так схематически выглядит молекула водорода.
Молекулярный водород, образованный из таких вот двухатомных молекул взрывается при поднесенной горящей спичке. Молекула водорода при взрыве распадается на атомы, которые превращаются в ядра гелия. Именно таким образом происходят ядерные реакции на Солнце и других звездах – за счет постоянного распадение молекул водорода наше светило горит и обогревает нас своим теплом.
Нахождение в природе, изучение его свойств
Звездная температура позволяет существовать водороду в виде плазмы. Это примерно 6000оС. Однако пространство между звездами заполнено отдельными молекулами, атомами и ионами, которые зачастую образовывают молекулярные скопления различных размеров и форм — облака. Плотность вещества при этом не является постоянной величиной, как и его температура.
В коре Земли водород считается десятым по распространенности элементом. Его массовая доля равна 1%. В то же время по числу атомов он достигает 17%. Это второе место после кислорода, доля которого равна 52%. Отсюда и значительная роль водорода в природе, особенно в химических превращениях.
Водород, в отличие от кислорода, не может существовать в свободном состоянии, только в связанном. Исключение составляет атмосфера, в сухом остатке которой 0,00005% простого вещества — водорода.
Все органические вещества включают в свой состав водород. Велика его доля в живых клетках (по количеству атомов его удельный вес достигает 63%).
В составе воды водород имеет большое значение в протекании геохимических процессов. Так, вулканические газы вызывают истечение определенных количестве водорода вдоль разломов (причина — рифтогенез). По этой же причине часто обнаруживают водород в районе угольных месторождений.
Натуральные минералы могут содержать Н2 в виде ионов аммония, гидроксил-ионов и воды.
Причина появления молекул Н2 в атмосфере — разложение формальдегида — участника окисления метана и прочих органических соединений. Кроме того, причина его образования — неполное сгорание топлива и биомассы, фиксация азота некоторыми микроорганизмами, содержащимися в воздухе.
Молекулы водорода легкие, поэтому имеют высокую тепловую скорость. При попадании в верхние слои атмосферы такие молекулы часто улетают в космос, при этом их потери могут достигать 3 кг каждую секунду.
Химические и физические свойства
Начиная говорить о химических свойствах водорода, нужно отметить чрезвычайную прочность его двухатомной молекулы. Для того, чтобы она распалась и атомы могли провзаимодействовать с другими участниками химической реакции, необходима энергия:
12H2→ 2H-432 кДЖ
Обычные температурные условия обеспечивают протекание реакций только с металлами высокой активности, к примеру, с кальцием:
12Ca+H2→ CaH2
Исключение составляет реакция с фтором, продуктом которой является фтороводород:
12F2+H2→ 2HF
Если имеется возможность повышения температуры (либо при другом воздействии, к примеру, освещении), водород может вступать в реакцию с большинством металлов и неметаллов:
12O2+2H2→ 2H2O
В реакциях с галогенами образуются галогеноводороды:
12H2+F2→ 2HF (в темноте происходит взрыв)
12H2+Cl2→ 2HCl (на свету происходит взрыв)
В реакции с оксидами водород проявляет восстановительные свойства:
12CuO+H2→ H2O+Cu
Высокая температура делает возможной реакцию с сажей:
12C+2H2→ CH4
Когда активные металлы соединяются с водородом, образуются гидриды, например гидрид натрия (NaH), гидрид кальция (CaH2), гидрид магния (MgH2). Эти солеобразные твердые, легко гидролизирующиеся вещества:
12CaH2+2H2→ Ca(OH)2+2H2
Оксиды металлов, реагируя с водородом, восстанавливаются с выделением воды:
12Fe2O3+3H2→ 2Fe+3H2O
Благодаря свойствам водорода, он нашел применение для восстановления органических веществ. Протекают реакции с участием катализатора, а также при высоких параметрах давления и температуры. К примеру, насыщенные алканы образуются в результате гидрирования ненасыщенных алкенов и алкинов.
Физические свойства водорода:
- В 14,5 раз легче воздуха. Поэтому молекулы движутся быстрее других молекул газов, передавая тепло.
- Имеет высокую теплопроводность (в 7 раз выше, чем у воздуха).
- Двухатомная молекула.
- Плотность — 0,08987 г/л, температура кипения-252,76оС, удельная теплота сгорания — 120,9*106Дж/кг, растворимость в воде — 18,8 мл/л
Хорошо растворяется в металлах, поэтому способен диффундировать в них. В серебре не растворим.

Электронная схема водорода
Порядок заполнения оболочек атома водорода (H) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Водород имеет 1 электрон, заполним электронные оболочки в описанном выше порядке:
1 электрон на 1s-подуровне
Степень окисления водорода
Атомы водорода в соединениях имеют степени окисления 1, 0, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Вычисление водорода
В химических реакциях наряду с жидкими и твердыми веществами участвуют и газы. Осуществление расчетов с газообразными веществами происходит обычно в единицах объема 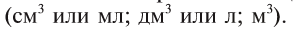
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул. Например, в 22,4 л любого газообразного вещества при 0°С и 101,325 кПа содержится 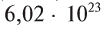
молекул.
Плотность газа р — это отношение молярной массы газа (М) к его молярному объему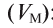
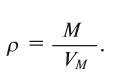
Относительная плотность газов рассчитывается как отношение их молекулярных масс по уравнению:
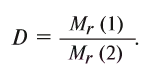
Вычисление объема газов по уравнениям химических реакций
Пример №1
Какой объем занимают 6,8 г 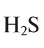
при нормальных условиях?
Решение:
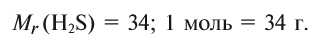
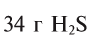
при нормальных условиях занимают объем 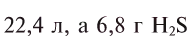
—х л.
Решая пропорцию, находим:
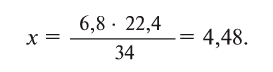
Ответ: 4,48 л.
Пример №2
Какой объем водорода при нормальных условиях выделится при растворении 3,25 г цинка в избытке соляной кислоты?
Решение:
Напишем уравнение реакции и уравняем его:
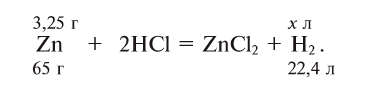
Составим на основе уравнения реакции пропорцию и решим задачу:
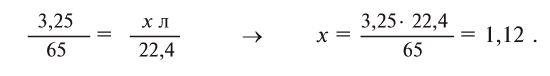
Ответ: 1,12 л.
Пример №3
Какой объем водорода необходим для восстановления 28,8 г FeO? Решение:
Составим уравнение реакции:
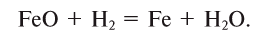
Из уравнения реакции видно, что на восстановление 1 моля (72 г) FeO нужен 1 моль (22,4 л) водорода.
Для восстановления 72 г FeO необходимо 22,4 л 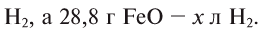
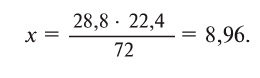
Ответ: 8,96 л.
Пример №4
Для получения кислорода в лабораторных условиях используют термическое разложение бертолетовой соли. Какой объем кислорода и какое количество КС1 образуется из 4,9 г этой соли при нормальных условиях?
Решение:
Напишем уравнение реакции разложения бертолетовой соли 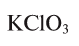
и уравняем его:
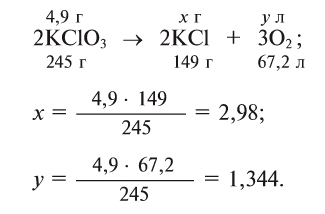
Ответ: 1,344 л 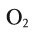
и 2,98 г КС1.
Вычисление объемных соотношений газов по химическим уравнениям
Пример №5
В каком объемном соотношении необходимо взять водород и кислород, чтобы они прореагировали без остатка? Какой объем кислорода вступает в реакцию с 10 л водорода?
Решение:
1) Напишем уравнение реакции взаимодействия кислорода с водородом:
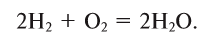
2Н2 + 02 = 2Н20.
Из уравнения известно, что 2 моля водорода без остатка реагируют с 1 молем кислорода.
2 моля водорода занимают объем 44,8 л, а 1 моль кислорода — 22,4 л. Объемные соотношения составят:
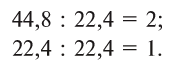
Следовательно, водород вступает без остатка в реакцию с кислородом при объемных соотношениях, составляющих небольшие целые числа — 2:1, т.е. 2 л водорода без остатка реаг ируют с 1 л кислорода.
2) Найдем объем кислорода, вступающего в реакцию с 10 л водорода. С 2 л водорода взаимодействует 1 л кислорода,
с 10 л — х л. х = 5 л.
Ответ: 2:1; 5л 
Вычисление абсолютной и относительной плотности газов
Пример №6
Рассчитайте абсолютную плотность фтористого водорода и его относительную плотность по водороду.
Решение:
1) Найдем плотность HF.
Молярная масса 1 моля HF — 20 г, а молярный объем — 22,4 л,
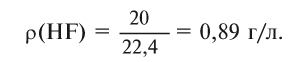
2) Найдем относительную плотность HF по
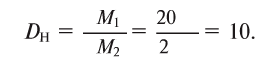
Пример №7
Относительная плотность паров серы по азоту при комнатной температуре равна 9,14. Определите формулу паров серы.
Решение:
Определим молярную массу паров серы.
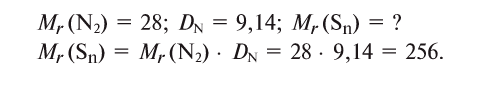
Если относительная молекулярная масса паров серы равна 256, то, поделив ее на относительную атомную массу серы — 32, мы получим число атомов в молекуле паров серы, т.е. 256 : 32 = 8.
Значит, формула паров серы —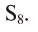
Способы получения водорода
Водород – газообразный элемент без цвета и запаха с плотностью 1/14 по отношению к воздуху. В свободном состоянии он встречается редко. Обычно водород соединен с другими химическими элементами: кислородом, углеродом.
Получение водорода для промышленных нужд и энергетики проводится несколькими методами. Самыми популярными считаются:
- электролиз воды;
- метод концентрирования;
- низкотемпературная конденсация;
- адсорбция.
Выделить водород можно не только из газовых или водных соединений. Добыча водорода производится при воздействии на дерево и уголь высокими температурами, а также при переработке биоотходов.

Атомный водород для энергетики получают, используя методику термической диссоциации молекулярного вещества на проволоке из платины, вольфрама либо палладия. Ее нагревают в водородной среде под давлением менее 1,33 Па. А также для получения водорода используются радиоактивные элементы.
Электролиз воды
Наиболее простым и популярным методом выделения водорода считается электролиз воды. Он допускает получение практически чистого водорода. Другими преимуществами этого способа считаются:
Принцип действия электролизного генератора водорода:
- доступность сырья;
- получение элемента под давлением;
- возможность автоматизации процесса из-за отсутствия движущихся частей.
Процедура расщепления жидкости электролизом обратен горению водорода. Его суть в том, что под воздействием постоянного тока на электродах, опущенных в водный раствор электролита, выделяются кислород и водород.
Дополнительным преимуществом считается получение побочных продуктов, обладающих промышленной ценностью. Так, кислород в большом объеме необходим для катализации технологических процессов в энергетике, очистки почвы и водоемов, утилизации бытовых отходов. Тяжелая вода, получаемая при электролизе, в энергетике используется в атомных реакторах.
Получение водорода концентрированием
Этот способ основан на выделении элемента из содержащих его газовых смесей. Так, наибольшая часть производимого в промышленных объемах вещества, извлекается с помощью паровой конверсии метана. Добытый в этом процессе, водород используют в энергетике, в нефтеочистительной, ракетостроительной индустрии, а также для производства азотных удобрений. Процесс получения H2 осуществляют разными способами:
- короткоцикловым;
- криогенным;
- мембранным.
Последний способ считается наиболее эффективным и менее затратным.
Конденсация под действием низких температур
Эта методика получения H2 заключается в сильном охлаждении газовых соединений под давлением. В результате они трансформируются в двухфазную систему, которая впоследствии разделяется сепаратором на жидкое составляющее и газ. Для охлаждения применяют жидкие среды:
- воду;
- сжиженный этан или пропан;
- жидкий аммиак.
Эта процедура не так проста, как кажется. Чисто разделить углеводородные газы за один раз не получится. Часть компонентов уйдет с газом, забираемым из сепарационного отсека, что не экономично. Решить проблему можно глубоким охлаждением сырья перед сепарацией. Но это требует больших энергозатрат.
В современных системах низкотемпературных конденсаторов дополнительно предусмотрены колонны деметанизации либо деэтанизации. Газовую фазу выводят с последней сепарационной ступени, а жидкость направляется в ректификационную колонну с потоком сырого газа после теплообмена.
Способ адсорбции
Во время адсорбции для выделения водорода используют адсорбенты – твердые вещества, поглощающие необходимые компоненты газовой смеси. В качестве адсорбентов применяют активированный уголь, силикатный гель, цеолиты. Для осуществления этого процесса применяют специальные аппараты – циклические адсорберы или молекулярные сита. При реализации под давлением этот метод позволяет извлекать 85-процентный водород.
Если сравнивать адсорбцию с низкотемпературной конденсацией, можно отметить меньшую материальную и эксплуатационную затратность процесса – в среднем, на 30 процентов. Методом адсорбции производят водород для энергетики и с применением растворителей. Такой способ допускает извлечение 90 процентов H2 из газовой смеси и получение конечного продукта с концентрацией водорода до 99,9%.
Добыча водорода в условиях домашнего хозяйства
Высокотемпературные методы производства водорода в домашних условиях неприменимы. Здесь чаще всего используют электролиз воды.
Для получения элемента дома необходим специальный аппарат – электролизер. Вариантов такого оборудования на рынке много, аппараты предлагают как известные технологические корпорации, так и мелкие производители. Брендовые агрегаты дороже, но качество их сборки выше.
Домашний прибор отличается малыми габаритами и легкостью в эксплуатации. Основными деталями его являются:
- риформер;
- система очистки;
- топливные элементы;
- компрессорное оборудование;
- емкость для хранения водорода.
В качестве сырья берется простая вода из-под крана, а электричество идет из обычной розетки. Сэкономить на электроэнергии позволяют агрегаты на солнечных батареях.
«Домашний» водород применяют в системах отопления или приготовления пищи. А также им обогащают бензовоздушную смесь, чтобы повысить мощность двигателей автомобиля.
Еще дешевле сделать прибор самому в домашних условиях. Сухой электролизер выглядит как герметичный контейнер, который представляет собой две электродные пластины в емкости с электролитическим раствором. Во Всемирной сети предлагаются разнообразные схемы сборки аппаратов разных моделей:
- с двумя фильтрами;
- с верхним либо нижним расположением контейнера;
- с двумя или тремя клапанами;
- с оцинкованной платой;
- на электродах.
Простой прибор для получения водорода создать несложно. Для него потребуются:
- листовая нержавеющая сталь;
- прозрачная трубка;
- штуцеры;
- пластиковая емкость (1,5 л);
- водяной фильтр и обратный клапан.
Помимо этого, нужны будут различные метизы: гайки, шайбы, болты. Первым делом нужно распилить лист на 16 квадратных отсеков, у каждого из них спилить угол. В противоположном от него углу требуется высверлить отверстие для болтового крепления пластин. Для обеспечения постоянного тока пластины нужно подключать по схеме: плюс–минус–плюс–минус. Изолируют эти детали друг от друга с помощью трубки, а на соединении болтом и шайбами (по три штуки между пластинками). На плюс и минус насаживают по 8 пластин.
При правильной сборке ребра пластинок не будут задевать электроды. Собранные детали опускают в емкость из пластика. В месте касания стенок болтами делают два установочных отверстия. Устанавливают защитный клапан для удаления избытка газа. В крышку контейнера монтируют штуцеры и герметизируют швы силиконом.
Чтобы протестировать аппарат, выполняют несколько действий:
- Наполняют жидкостью.
- Прикрыв крышкой, соединяют один конец трубки со штуцером.
- Второй опускают в воду.
- Подключают к источнику питания.
После включения прибора в розетку через несколько секунд будет заметен процесс электролиза и выпадение осадка.
Чистая вода не обладает хорошей электропроводностью. Для улучшения этого показателя нужно создать электролитический раствор, добавив щелочь – гидроксид натрия. Он есть в составах для очищения труб наподобие «Крота».
Практическое применение
Так как водород в 14 раз легче воздуха, то в былые времена им начиняли воздушные шары и дирижабли. Но после серии катастроф произошедших с дирижаблями конструкторам пришлось искать водороду замену (напомним, чистый водород – взрывоопасное вещество, и малейшей искры было достаточно, чтобы случился взрыв).

Взрыв дирижабля Гинденбург в 1937 году, причиной взрыва как раз и стало воспламенение водорода (вследствие короткого замыкания), на котором летал этот огромный дирижабль.
Поэтому для подобных летательных аппаратов вместо водорода стали использовать гелий, который также легче воздуха, получение гелия более трудоемкое, зато он не такой взрывоопасный как водород.
Тем не менее, водород весьма хорошо зарекомендовал себя в качестве одного из компонентов ракетного топлива. А автомобили, работающие на водородном топливе более экологичнее своих дизельных и бензиновых собратьев.
Также с помощью водорода производится очистка различных видов топлива, в особенности на основе нефти и нефтепродуктов.
Существующие установки
Спрос на водород растет в связи с переходом на потребление более чистых и легких нефтяных топлив, в то время как нефтяное сырье становится все тяжелее. В связи с этим трудно представить современный НПЗ без установки производства водорода. УПВ может отсутствовать только в составе НПЗ, работающих по профилю первичной переработки нефти. Стоит отметить, что для производств, обладающих развитой архитектурой вторичных процессов, ресурсов одной УПВ может быть недостаточно.