- Кислород: общая информация
- История открытия
- Строение атома кислорода
- Электронное строение кислорода
- Кислород как простое вещество
- Элемент в окружающей среде
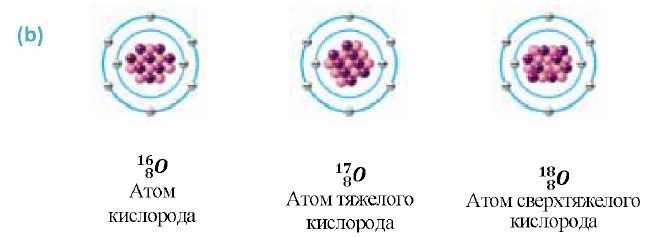
- Изотопы кислорода
- Применение кислорода
- Биологическая роль кислорода
- Кислород и воздух
- Круговорот кислорода в природе
- Получение
- Перегонка жидкого воздуха
- Разложение кислородсодержащих веществ
- Электролиз водных растворов
- Разложение хлората калия
- Разложение нитратов
- Разложение оксида ртути (II)
- Разложение пероксида водорода
- Разложение перманганата калия
- Реакция перекисных соединений с углекислым газом
- Физические свойства
- Химические свойства
- Горение и кислород
Кислород: общая информация
Кислород – неметалл, в нормальных условиях не имеющий цвета, вкуса и запаха.
Практически во всех соединениях, кроме соединений с фтором и пероксидов, он проявляет постоянную валентность II и степень окисления -2. Атом кислорода не имеет возбужденных состояний, так как на втором внешнем уровне нет свободных орбиталей. Как простое вещество кислород существует в виде двух аллотропных видоизменений – газов кислорода O2 и озона O3.
при определенных условиях кислород может находится в жидком или твердом состоянии. они в отличие от газа имеют цвет: жидкий – светло-голубого цвета, а твердый кислород имеет светло-синий оттенок.

Кислород в промышленности получают с помощью сжижения воздуха с последующим отделением азота за счет его испарения (имеется разница в температурах кипения: -183 градуса для жидкого кислорода и -196 градусов для жидкого азота).
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли первого августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).2HgO (t) → 2Hg + O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провел опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.

Строение атома кислорода
В атоме кислорода 8 электронов, которые располагаются на двух электронных слоях (рис. 44):
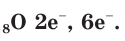
На внешнем электронном слое у атома кислорода находится 6 электронов, следовательно, до завершения этого слоя ему не хватает 2 электронов. Поэтому в своих
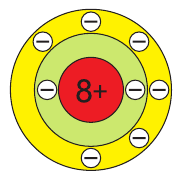

соединениях с металлами и водородом кислород обычно проявляет степень окисления, равную –2, как, например, в оксиде железа FeO. Кислород — второй по электроотрицательности химический элемент после фтора, поэтому только атомы фтора способны отнимать у него электроны. Положительную степень окисления +2 кислород проявляет только в соединении со фтором 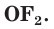
.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии:
+8O 1s22s22p4 1s 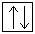
2s 
2p 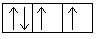
Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Кислород как простое вещество
Получение:
В лаборатории кислород получают следующими способами.
1. Термическим разложением перманганата калия:
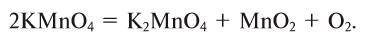
2. Термическим разложением бертолетовой соли в присутствии катализатора:
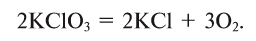
3. Термическим разложением нитратов щелочных металлов:
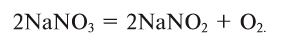
4. Электролизом воды (рис. 19):
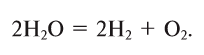

Рис. 19. При электролизе воды образуется один объем кислорода и два объема 4
5. Пероксид водорода в присутствии катализатора оксида марганца (IV) разлагается на воду и кислород (рис. 20):
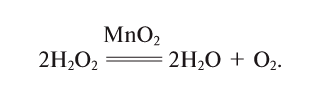
В промышленности кислород получают электролизом воды или из жидкого воздуха.
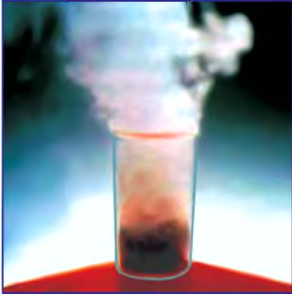
Рис. 20. Разложение 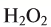
присутствии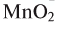
Понятие о катализаторах:
Если обратить внимание на реакцию получения кислорода посредством разложения пероксида водорода, то можно увидеть, что этот процесс осуществляется очень быстро в присутствии черного порошка — оксида марганца (IV) — 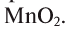
. Кислород начинает интенсивно выделяться, и после реакции в сосуде остаются вода и неизрасходованный порошок.
Если отделить фильтрованием порошок, находящийся на дне сосуда, и высушить его, то можно заметить, что его исходные масса и свойства не изменились. Им можно пользоваться при разложении других образцов пероксида водорода.
Вещества, участвующие в химической реакции и ускоряющие ее, но которые при этом не расходуются и не изменяются, называются катализаторами.
Процесс, протекающий в присутствии катализатора, называется катализом.

Рис. 21. Притяжение кислорода к магниту
Физические свойства:
Молекула кислорода состоит из двух атомов и как простое вещество выражается формулой 02. Относительная молекулярная масса равна 32. При обычных условиях кислород — газ без цвета, вкуса и запаха. Он немного тяжелее воздуха (1 л кислорода весит 1,43 г, а 1 л воздуха — 1,293 г). Кислород мало растворяется в воде: при 0°С в 1 л — 49 мл кислорода, при 20°С в 1л — 31 мл кислорода. Приблизительно при 1500°С кислород расщепляется на атомы. При —183°С кислород превращается в голубоватую жидкость. Жидкий кислород способен притягиваться к магниту (рис. 21).
Озон:
При пропускании через кислород или воздух электрической искры (или грозового разряда) образуется новое вещество с характерным запахом — озон. Возможность получения озона из чистого кислорода доказывает, что он является его аллотропическим видоизменением и состоит из атомов кислорода:
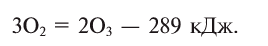
Озон постоянно образуется в стратосфере (слой атмосферы на высоте 23—25 км от Земли) под действием ультрафиолетовых лучей, а также в результате окисления смолистых веществ хвойных растений. Озоновый слой составляет в толщину 2—4,5 мм, он защищает Землю от губительной солнечной радиации (вредных лучей). Нарушение целостности озонового слоя чрезвычайно опасно для жизни на Земле. Поэтому ученые постоянно проводят исследования по изучению причин появления озоновых дыр и мер по их предупреждению.
Озон разъедает резину, обесцвечивает масло и бумагу, убивает бактерии. Он используется при усовершенствовании технологических процессов в промышленности, при очистке дымовых газов, промышленных и бытовых стоков, а также при дезинфекции питьевой воды.
Озон — газ голубого цвета с характерным запахом, в воде растворяется лучше, чем кислород (при 0°С в 1 л воды 490 мл).
Озон легко разлагается: 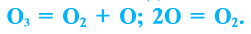
В лаборатории озон получают с помощью озонатора.
Озон отделяют от кислорода путем сильного вымораживания (озон кипит при температуре -111,9°С).
Озон ядовит. Его количество в воздухе не должно превышать 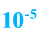
%.
Серебро не взаимодействует с кислородом, но при взаимодействии с озоном дает оксид.
Химические свойства кислорода:
Кислород (после фтора) — самый активный неметалл.
Кислород поддерживает горение.
Кислород соединяется почти со всеми металлами (окисляет их), кроме золота, серебра, платины и металлов группы платины:
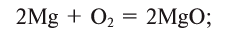
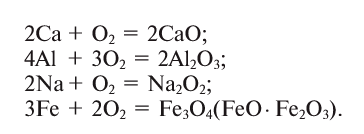
Кислород вступает в реакцию также со всеми неметаллами, кроме галогенов (элементов VII группы главной подгруппы), образуя оксиды:
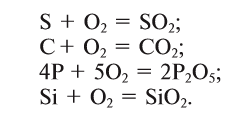
Кислород также вступает в реакцию со сложными органическими и неорганическими веществами:
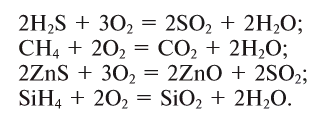
Оксиды — это вещества, образующиеся в результате взаимодействия кислорода и большинства простых или сложных веществ.
В оксидах кислород двухвалентен.
Элемент в окружающей среде
Земная кора состоит в основном из кремниево-кислородных минералов, и многие другие элементы присутствуют в виде их оксидов. Газообразный кислород составляет пятую часть атмосферы. О2 в атмосфере Земли образуется в результате фотосинтеза растений, он накапливался в течение длительного времени, поскольку они использовали обильные запасы углекислого газа в ранней атмосфере и выделяли кислород.
Элемент хорошо растворяется в воде, что делает возможной жизнь в реках, озёрах и океанах. Вода в этих водоёмах должна регулярно снабжаться кислородом, поскольку, когда запасы О2 в ней истощаются, она больше не может поддерживать рыбу и другие водные организмы.
Почти все химические вещества, кроме инертных газов, связываются с кислородом с образованием соединений. Вода, H2O и кремнезём, SiO2, основной компонент песка, являются одними из наиболее распространённых двойных кислородных соединений. Среди соединений, которые содержат более двух элементов, наиболее распространёнными являются силикаты, которые образуют большинство пород и почв. Другими соединениями, которые в изобилии встречаются в природе, являются карбонат кальция (известняк и мрамор), сульфат кальция (гипс), оксид алюминия (боксит) и различные оксиды железа, которые используются в качестве источника металла.
Элемент встречается во всех видах минералов. Некоторые общие примеры включают оксиды, карбонаты, нитраты, сульфаты и фосфаты. Оксиды — это химические соединения, которые содержат кислород и ещё один элемент. Карбонаты — это соединения, которые содержат кислород, углерод и ещё один элемент. В качестве примера можно привести карбонат натрия или соду, кальцинированную соду или солевую соду (Na2CO3), которая часто встречается в моющих и чистящих средствах.
Нитраты, сульфаты и фосфаты также содержат кислород. Другими элементами в этих соединениях являются азот, сера или фосфор плюс ещё один элемент. Примерами этих соединений являются нитрат калия или селитра (KNO3), сульфат магния или соли Эпсома (MgSO4) и фосфат кальция (Ca3 (PO 4)2).
Изотопы кислорода
Есть три естественных изотопа О2: кислород-16, кислород-17 и кислород-18. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Известно также пять радиоактивных изотопов элемента. Радиоактивный изотоп — это тот, который распадается на части и испускает некоторую форму радиации. Радиоактивные изотопы образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение кислорода
Молекулярный диоксид O2 необходим для клеточного дыхания у всех аэробных организмов. Его реакционноспособные виды, такие как супероксид-ион (O2-) и пероксид водорода (H2O2), являются опасными побочными продуктами использования кислорода в организмах. Однако части иммунной системы высших организмов используют реактивный пероксид, супероксид и синглетный кислород для уничтожения вторгающихся микробов. Реактивные виды также играют важную роль в гиперчувствительной реакции растений на воздействие патогенных микроорганизмов.
В состоянии покоя взрослый человек вдыхает от 1,8 до 2,4 г кислорода в минуту. Это составляет более 6 миллиардов тонн элемента, вдыхаемого человечеством в год. Сферы использования включают в себя следующие:
- Люди, у которых есть проблемы с дыханием, используют кислородные маски и резервуары, чтобы получить необходимый им кислород.
- Он используется в ракетном топливе, сочетается с водородом в двигателе. Когда водород и кислород объединяются, они выделяют очень большое количество энергии. Энергия используется для запуска ракеты в космос.
- На производство металла приходится самый большой процент использования О2. Например, элемент используется для сжигания углерода и других примесей, которые содержатся в железе для производства стали. Небольшое количество этих примесей может быть полезным для стали, но слишком большое делает его ломким и непригодным для использования. Углерод и другие примеси сжигаются при производстве стали путём продувки О2 через расплавленное железо.
- Используется при производстве таких металлов, как медь, свинец и цинк. Эти металлы встречаются в земле в форме сульфидов, таких как сульфид меди (CuS), сульфид свинца (PbS) и сульфид цинка (ZnS). Первым шагом в извлечении этих металлов является превращение их в оксиды. Затем оксиды нагревают с углеродом, чтобы получить чистые металлы.
- Применяется в химической промышленности в качестве исходного материала для производства некоторых очень важных соединений. Иногда этапы перехода от кислорода к конечному соединению являются длительными. Например, газообразный этилен (C2H4) может быть обработан кислородом с образованием этиленоксида (CH2CH2O). Около 60% полученного этиленоксида превращается в этиленгликоль (CH2CH2 (OH)2). Этиленгликоль используется в качестве антифриза и служит отправной точкой при производстве полиэфирных волокон, плёнки, пластиковых контейнеров, пакетов и упаковочных материалов
- Используется в оксиацетиленовой сварке, в качестве окислителя для ракетного топлива, а также в производстве метанола и этиленоксида.
- Растения и животные используют его для дыхания.
- Чистый кислород часто используется для облегчения дыхания у пациентов с респираторными заболеваниями.

Кислород и его соединения играют ключевую роль во многих важных процессах жизни и промышленности
Биологическая роль кислорода

Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Кислород и воздух
Атмосферный воздух — это природная смесь многих газов. Помимо азота и кислорода, являющихся основной составной частью воздуха, в его состав входят в небольшом количестве инертные газы, углекислый газ, пары воды и водород (табл. 6). Кроме них, в воздухе встречаются, в зависимости от внешних условий, пыль, некоторые случайные примеси. Кислород, азот и инертные газы являются постоянными составляющими воздуха, они встречаются в любом месте почти в одинаковом количестве. Содержание же углекислого газа, паров воды и пыли изменяется в зависимости от условий.
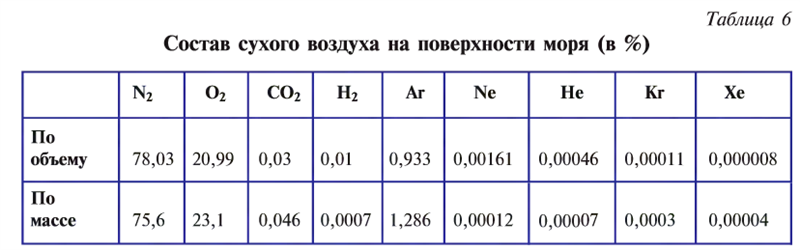
Один литр воздуха при 20°С и нормальном атмосферном давлении весит 1,293 г. При —192°С и давлении 101,33 кПа воздух превращается в бесцветную прозрачную жидкость. Из жидкого воздуха выделяются азот, кислород и инертные газы.
Углекислый газ и водяные пары воздуха выполняют функцию защитного экрана, препятствующего распространению во Вселенной тепла Земли, а озон не пропускает губительные для жизни на Земле коротковолновые ультрафиолетовые лучи, исходящие от Солнца и звезд. Твердые частицы воздуха (пыль) служат основой для образования дождевых капель (в состав пыли входят минеральные вещества, частицы угля, растительная пыль и различные бактерии).
К случайным примесям воздуха относятся сероводород и аммиак, образующиеся при гниении органических остатков, выбрасываемый промышленными предприятиями сернистый газ, образующиеся в результате электрических разрядов оксиды азота, которые периодически выводятся из состава воздуха дождем и снегом.
Воздух является необходимой составной частью жизни на Земле. Сохранение его чистоты имеет огромное значение для человечества. Для защиты воздуха от техногенных загрязнений необходимо использовать новые безотходные технологии, предупреждать уменьшение биомассы Земли, обеспечивать нормальную работу естественных механизмов очистки воздуха.
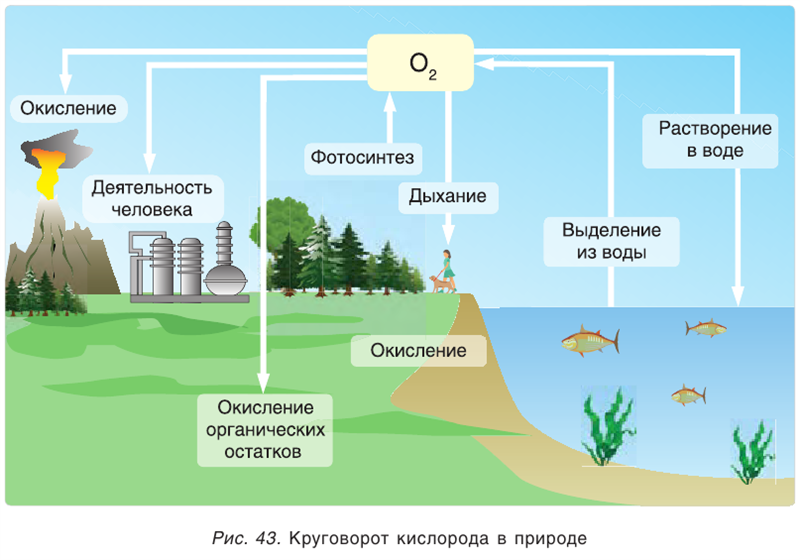
Круговорот кислорода в природе
О том, что кислород в большом количестве находится в литосфере, гидросфере и атмосфере, мы говорили в предыдущих разделах учебника (табл. 5).

Круговорот кислорода на Земле несущественно отличается от его круговорота в атмосфере, литосфере и гидросфере. На Земле круговорот в основном протекает в процессе фотосинтеза и дыхания. В процессе фотосинтеза углекислый газ, взаимодействуя с водой, образует органические вещества и кислород. В результате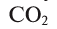
расходуется на образование биомассы. При этом кислород, входящий в состав воды в виде 02, полностью переходит в атмосферу. Таким образом, фотосинтез обеспечивает переход кислорода из гидросферы в атмосферу, а затем в биосферу (выделение кислорода из молекулы воды обозначено знаком *):
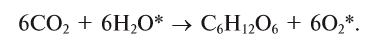
При дыхании, разложении умерших организмов и горении кислород из биосферы возвращается обратно в гидросферу и атмосферу:
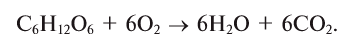
В биомассе Земли кислород полностью меняется каждые 20—30 лет. В литосферу кислород переходит из атмосферы в виде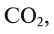
, который связывается и превращается в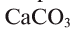
(например, в раковинах моллюсков), а затем эти карбонаты при термическом разложении образуют углекислый газ, который возвращается в атмосферу: 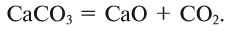
Эта реакция наблюдается в основном в зонах повышенной вулканической деятельности, тем самым постепенно обновляя углекислый газ в атмосфере.
Получение
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.

Перегонка жидкого воздуха
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии, а также использующие принцип адсорбции.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.

Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
2KMnO4→tK2MnO4+MnO2+O2↑{displaystyle {ce {2KMnO4 ->[t] K2MnO4 + MnO2 + O2 ^}}}
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца(IV):
2H2O2→MnO22H2O+O2↑{displaystyle {ce {2H2O2 ->[MnO2] 2H2O + O2 ^}}}
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3⟶2KCl+3O2↑{displaystyle {ce {2KClO3 -> 2KCl + 3O2 ^}}}
Разложение оксида ртути(II) (при t = 100 °C) было первым методом синтеза кислорода:
2HgO→100°C2Hg+O2↑{displaystyle {ce {2HgO ->[100{°}C] 2Hg + O2 ^}}}
Электролиз водных растворов
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
2H2O→e−2H2↑+O2↑{displaystyle {ce {2H2O ->[e^-] 2H2 ^ + O2 ^}}}
Разложение хлората калия
Хлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
2KClO3 t°, MnO2 → 2KCl + 3O2↑.
Разложение нитратов
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:
Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ.
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые В общем виде реакцию разложения можно описать буквенной схемой:
АВ → А + В.
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
Разложение пероксида водорода
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2 Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
2H2O2 MnO2 → 2H2O + O2↑
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее.
Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
2KMnO4 t° → K2MnO4 + MnO2 + O2↑
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает!Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
Реакция перекисных соединений с углекислым газом
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
2Na2O2+2CO2⟶2Na2CO3+O2↑{displaystyle {ce {2Na2O2 + 2CO2 -> 2Na2CO3 + O2 ^}}}
Для соблюдения баланса объёмов поглощённого углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Физические свойства
Холодная вода содержит больше растворенного O2.
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при 50 °C) и спирте (2,78 мл/100 г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
Фазовая диаграмма O2
Твёрдый кислород (температура плавления −218,35°C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53° [4] .
- β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25° [4] .
- γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å [4] .
Ещё три фазы образуются при высоких давлениях:
- δ-О2 интервал температур 20-240 К и давление 6-8 ГПа, оранжевые кристаллы;
- ε-О4 давление от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-Оn давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 + 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S + O2 → SO2
Si + O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P + 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P + 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Графит также горит, например, в жидком кислороде:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Al4C3 + 6O2→ 2Al2O3 + 3CO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 + O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 + O2 → 2CH3=CH=O
Горение и кислород
Рассмотренные в предыдущем параграфе реакции с участием кислорода сопровождаются одинаковыми внешними эффектами.
Химическую реакцию, во время которой выделяется теплота и появляется пламя, называют горением.
Пламя возникает вследствие свечения раскаленных частиц веществ, которые сгорают или образуются во время реакции.
Для того чтобы горючее вещество воспламенилось, необходимы такие условия:
- наличие кислорода (воздуха);
- нагревание вещества до температуры самовозгорания (для бензина она составляет 220 °С, сухой древесины — 250—300 °С, бумаги — 440 °С, угля — свыше 600 °С).
Кислород поддерживает горение веществ, но сам не горит.
Если не выполняется хотя бы одно из этих условий, то горение не происходит. Это учитывают во время работы с огнеопасными веществами, а также при тушении пожаров.
Погасить огонь можно, залив горящее вещество или предмет водой, засыпав его песком или землей, накрыв одеялом или направив на него струю углекислого газа (он не поддерживает горения и тяжелее воздуха) (рис. 63).
Рис. 63. Гашение пламени:
а — водой; б — песком; в — углекислым газом
В лабораториях, на предприятиях с этой целью используют огнетушители (рис. 64).
Окисление и кислород
Взаимодействие веществ с кислородом не всегда сопровождается их горением. Большинство таких реакций происходят медленно, иногда — незаметно. Вещество, которое взаимодействует с кислородом, подвергается окислению, т. е. изменяется при участии кислорода.
Медленным окислением веществ обусловлено появление ржавчины на железе, прокисание молока, прогорание масла, порча многих других продуктов питания.
Реакции веществ с кислородом, которые не сопровождаются горением, используют в цветной металлургии, химической промышленности.
Кислород, поступая через легкие в организм животного или человека, окисляет различные вещества, в том числе и те, которые постоянно поступают вместе с пищей.
Выводы:
При взаимодействии некоторых веществ с кислородом происходит их горение — химическое превращение с выделением теплоты и появлением пламени.
Условиями, необходимыми для горения, являются наличие кислорода и достижение веществом определенной температуры. Для того чтобы погасить пламя, необходимо устранить хотя бы одно из этих условий.
Любую реакцию вещества с кислородом называют окислением. Многие из таких реакций происходят медленно и не сопровождаются появлением пламени.