- Что такое кристаллическая решетка
- Общая характеристика
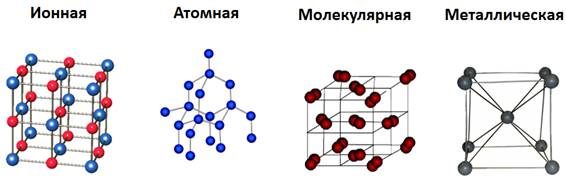
- Виды решеток
- Молекулярная кристаллическая решетка
- Ионная кристаллическая решетка
- Металлическая кристаллическая решетка
- Молекулярно-кинетическая теория
- Атомная кристаллическая решетка
- Строение и агрегатное состояние веществ
- Как определить кристаллическую решетку
- Пять типов кристаллических решеток
- Кубическая (или изометрическая) решетка
- Орторомбическая кристаллическая решетка
- Моноклинная решетка
- Триклинная решетка
- Ромбоэдрическая решетка
- Сравнение свойств веществ с различными кристаллическими решетками
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
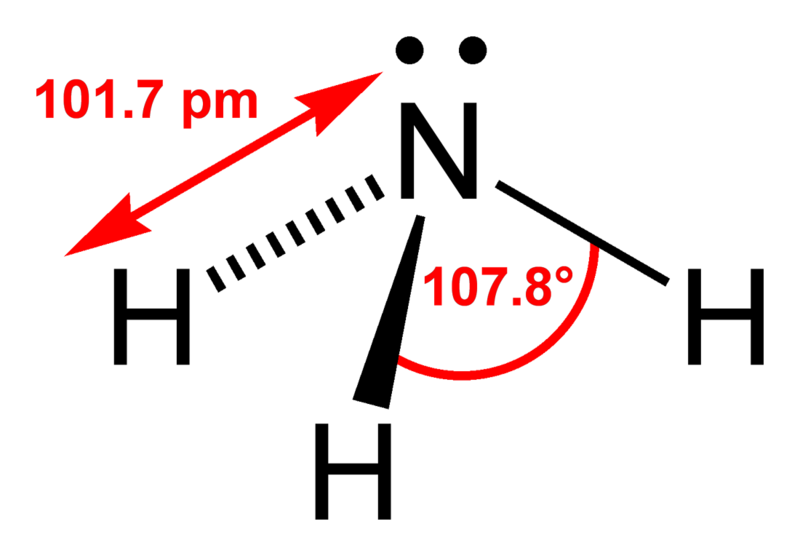
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
- атомная (ковалентные связи),
- молекулярная (ковалентные связи и притяжение между молекулами),
- металлическая (металлические связи),
- ионная (ионные связи).
Важно! Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.

Общая характеристика
Существует огромное количество кристаллических структур. Их объединяет главное свойство кристаллического состояния вещества — закономерное положение атомов в кристаллической решётке. Одно и то же вещество может кристаллизоваться в разных кристаллических решётках и обладать весьма различными свойствами (классический пример графит — алмаз). В случае простых веществ это явление называется аллотропией, в общем случае любых химических соединенй — полиморфизмом. В то же время, разные вещества могут образовывать однотипные, или изоморфные, решётки, как, например, решётки многих металлов: меди, алюминия, серебра, золота. Иногда происходит замещение атомов в кристаллической решётке на атомы другого химического элемента с образованием твёрдого раствора.
В зависимости от пространственной симметрии, все кристаллические решётки подразделяются на семь кристаллических систем. По форме элементарной ячейки они могут быть разбиты на шесть сингоний. Все возможные сочетания имеющихся в кристаллической решётке поворотных осей симметрии и зеркальных плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии, а с учётом винтовых осей симметрии и скользящих плоскостей симметрии на 230 пространственных групп.
Помимо основных трансляций, на которых строится элементарная ячейка, в кристаллической решётке могут присутствовать дополнительные трансляции, называемые решётками Браве. В трёхмерных решётках бывают гранецентрированная (F), объёмноцентрированная (I), базоцентрированная (A, B или C), примитивная (P) и ромбоэдрическая (трансляций состоит из множества векторов (a, b, c), во все остальные входят одна или несколько дополнительных трансляций. Так, в объёмноцентрированную систему трансляций Браве входит четыре вектора (a, b, c, ½(a+b+c)), в гранецентрированную — шесть (a, b, c, ½(a+b), ½(b+c), ½(a+c)). Базоцентрированные системы трансляций содержат по четыре вектора: A включает вектора (a, b, c, ½(b+c)), B — вектора (a, b, c, ½(a+c)), а C — (a, b, c, ½(a+b)), центрируя одну из граней элементарного объёма. В системе трансляций Браве R дополнительные трансляции возникают только при выборе гексагональной элементарной ячейки и в этом случае в систему трансляций R входят вектора (a, b, c, 1/3(a+b+c), —1/3(a+b+c)).
Решетки Браве
 Гранецентрированная F | 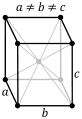 Объёмноцентрированная I | 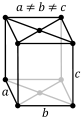 Базоцентрированная C | 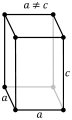 Примитивная |
Виды решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
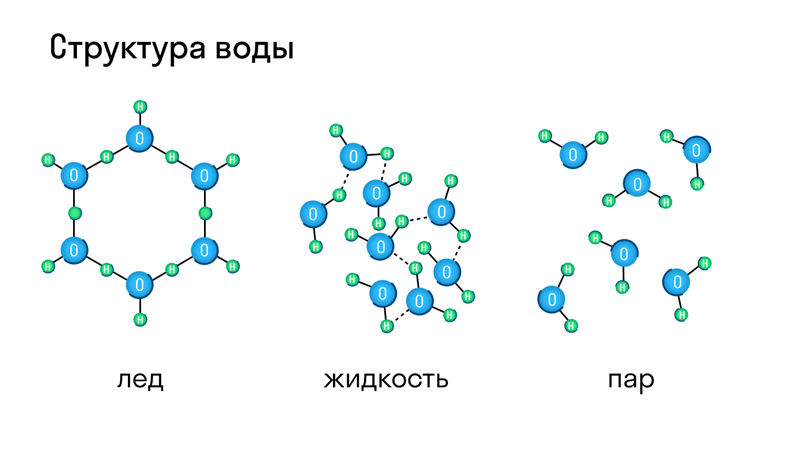
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).

Свойства молекулярных веществ:
- небольшая твердость;
- низкая прочность;
- легкоплавкость;
- летучесть;
- у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).

Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
- твердость;
- хрупкость;
- тугоплавкость;
- нелетучесть;
- электропроводность;
- способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.

Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
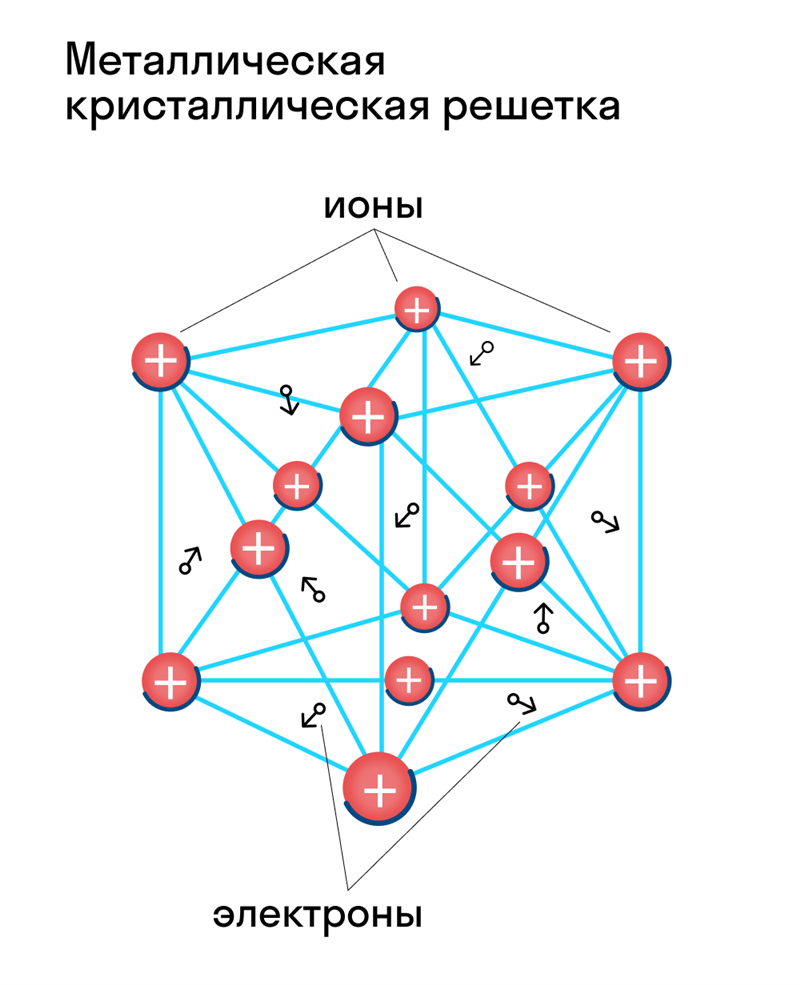
Свойства веществ с металлической кристаллической решеткой:
- характерный блеск;
- хорошая ковкость;
- высокая теплопроводность;
- электропроводность.
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Тип решеткиЧастицы в узлах решеткиТип связи между частицамиПримеры веществФизические свойства веществ
| Атомная | Атомы | Ковалентная связь | Твердые неметаллы: графит, кремний, бор, германий и другие. | При обычных условиях прочные и твердые, тугоплавкие, нерастворимые в воде, нелетучие. |
| Молекулярная | Молекулы | Силы притяжения между молекулами | Вещества, образующие маленькие молекулы (CO2, Cl2, H2O), благородные газы, органические вещества. | При обычные условиях — газы или жидкости. Легкоплавкие, летучие, некоторые способны к возгонке. |
| Ионная | Ионы | Ионная связь | Соли, большая часть органических соединений, оксиды, щелочи. | Твердые, тугоплавкие, хрупкие, нелетучие, растворимы в воде, способны проводить электроток. |
| Металлическая | Атомы и ионы | Металлическая связь | Все металлы и сплавы. | Твердые (кроме ртути), ковкие, имеют блеск, отличаются теплопроводностью, электропроводностью. |
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом– это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность– это способность вещества деформироваться без разрушения.

Электропроводность– это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

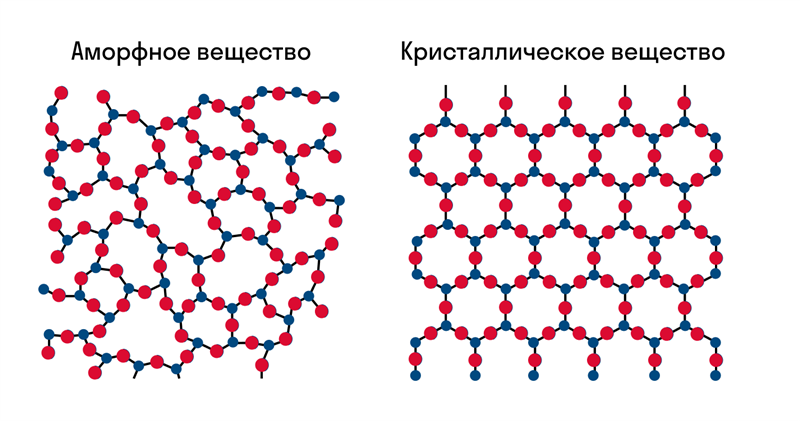
В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.

Аморфный бор
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлахкристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Атомная кристаллическая решетка

Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы. Атомы соединены между собой прочными ковалентными химическими связями. Соответственно, такая кристаллическая решетка будет очень прочной, разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др.). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет. Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками. Это общие закономерности, из которых есть ряд исключений.
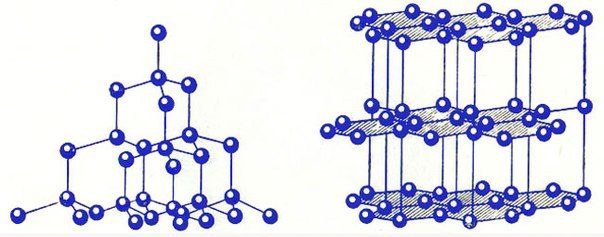
Связь между частицами в атомных кристаллах: ковалентная полярная или неполярная .
В узлах кристаллас атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Вещества, образующие в твердом состоянии атомные кристаллы:
- Простые веществас высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO2; карбид кремния (карборунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
- Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
- Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые сложнее разорвать.
- Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.
Как определить кристаллическую решетку
Как понятно из предыдущего материала, строение вещества, его состав и физические характеристики тесно связаны. Поэтому для определения вида кристаллической решетки можно руководствоваться теми данными, которые у нас есть. Как правило, известен состав вещества, а значит, мы можем сделать вывод о химических связях внутри его молекулы, что позволит в свою очередь предположить тип решетки.
Также можно провести быстрый анализ:
- если это неметалл, который при комнатной температуре представляет собой твердое тело — скорее всего он имеет атомную решетку;
- если в обычных условиях это жидкость или газ либо речь об органическом веществе — предполагаем молекулярную решетку;
- если это соль либо щелочь — кристаллы имеют ионную решетку;
- если это металл или сплав — решетка точно будет металлической.
Пять типов кристаллических решеток
Есть семь разных кристаллических систем. Они были обнаружены в 1781 году отцом Рене Джаст Хауи. Он случайно заметил, что некоторые камни имеют идеальную форму. После многих лет исследований он разработал свою теорию о структуре кристаллов. В 1848 году Огюст Браве показывает, что может быть только семь типов элементарной кристаллической сетки.
Системы характеризуют различные геометрические формы, которые может иметь кристаллическая сетка.
Каждая из этих систем определяется своими осями: три размерных параметра (длина осей) и три угловых параметра (углы, образованные двумя осями). Условно мы называем abc длинами осей и α β и γ углами, образованными осями. Они размещены в пространстве следующим образом:
Каждая ячейка, представляющая систему, также имеет определенное количество симметрий. Эти симметрии бывают трех типов:
- центральный (отмечен С): точка является центром симметрии сетки;
- плоскости (отмечено P): плоскость является плоскостью симметрии сетки;
- осевой (О): поворот на определенный угол вокруг оси симметрии возвращает сетку в положение, идентичное исходному.
Эти симметрии имеют четыре порядка:
- двоичные ( обозначено L 2 ): вращение на 180 ° (π рад)
- троичное (обозначено L 3 ): вращение на 120 ° (2π/3 рад)
- четвертичное (отмечено L 4 ): Вращение на 90 ° (π/2 рад.)
- гексагональное (отмечено L 6 ): вращение на 60 ° (π/3 рад.)
Кубическая (или изометрическая) решетка
| a = b = c: три оси имеют одинаковую длину α = β = γ= 90 °: три угла равны и прямые Симметрии: C, 3 L 4 , 4 L 3, 6L 2, 9 P Базовый элемент — это куб. |
Орторомбическая кристаллическая решетка
| a ≠ b ≠ c: три оси имеют разную длину α = β = γ= 90 °: три угла равны и прямые Симметрии: C, 3 L 2, 3 P Основной элемент — прямоугольный параллелепипед. |
Моноклинная решетка
| a≠b≠c : три оси имеют неравную длину. β = γ= 90 °≠α: два угла равны и прямые. Симметрии: C, L 2 , P Основным элементом является наклонная призма, в основании которой ромб. |
Триклинная решетка
| a≠b≠c: три оси имеют неравную длину. α≠β ≠ γ≠ 90 °: три угла разные. Симметрии: C, L 2 , P Основной элемент — это параллелепипед с основанием ромб. |
Ромбоэдрическая решетка
| a = b = c: три оси имеют одинаковую длину α = β = γ≠ 90 °: три угла равны и прямые Симметрии: C, L 3 , 3 L 2 , P Основным элементом является параллелепипед все плоскости которого — ромбы. |
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.
Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).
Итоговая таблица связи свойств веществ со строением: