Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк .
Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий .
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопках. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
2CO+(CuOH)2CO3→2Cu+3CO2+H2O{displaystyle {mathsf {2CO+(CuOH)_{2}CO_{3}rightarrow 2Cu+3CO_{2}+H_{2}O}}}
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 см по сторонам и 0,5 мм толщиной. Монета имела хождение по всему западному побережью Южной Америки, в том числе и в государстве Инков [5] .
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике [6] .
- Состав и структура
- Химическая формула меди
- Электронная формула меди
- Происхождение и нахождение
- Запасы, добыча
- Методы добычи
- Характеристика и особенности
- Физические характеристики
- Химические свойства
- Соединения
- Возможные степени окисления
- Простое вещество
- Аналитическая химия меди
- Прочие свойства
- Переработка
- Богатство основного цвета и разнообразие оттенков
- Цвета медных сплавов
- Особенности популярных медных сплавов
- Отличие от других элементов
- Сферы применения
Состав и структура
Медь — соединение огромного количества кристаллов серебра, кальция, золота, свинца, никеля. Металлы, из которых состоит купрум, отличаются простотой обработки, относительной пластичностью.
Элементарная ячейка структурной решетки — кубическая форма. Каждая из ячеек представляет собой соединение 4 атомов.
Во время добычи руда насыщена огромным количеством примесей. Они влияют на технические характеристики переплавленного металла, его структуру. Распространенные примеси:
- Кислород — примесь, содержание которой в составе может достигать 0,008%. Под воздействием высоких температур содержание кислорода быстро сокращается.
- Висмут — компонент, который негативно сказывается на технических характеристиках готового металла. Допустимое количество в составе — до 0,001%.
- Марганец — практически не влияет на свойства купрума.
- Никель — снижает теплопроводность.
- Мышьяк — не влияет на свойства переплавленного металла. Мышьяк нейтрализует негативное воздействие висмута, кислорода, сурьмы на конечный материал.
- Олово — усиливает теплопроводность.
- Сурьма — снижает тепло- и электропроводность. Допустимое содержание в составе — до 0,05%.
- Сера, селен — снижают показатель пластичности, если их количество в составе превышает 0,001%.
- Цинк — практически не влияет на физические, химические свойства.
- Фосфор — главный раскислитель. Улучшает механические свойства.
Процентное содержание примесей при производстве может уменьшаться или увеличиваться.
Медная руда
Химическая формула меди
Химическое обозначение меди – Cu от латинского слова «cyprum». Этот химический элемент расположен в четвертом периоде в IВ группе Периодической таблицы Д.И. Менделеева.Относится к элементам d-семейства. Металл. Относительная атомная масса меди равна 63,546 а.е.м.
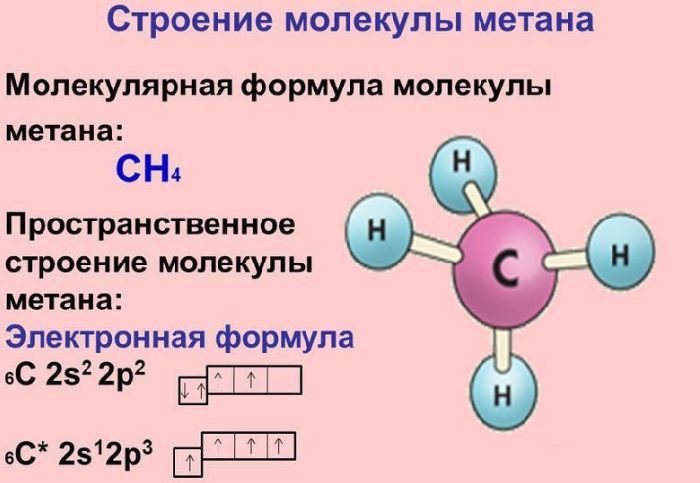
Электронная формула меди
В ядре атома меди содержится 29 протонов и 35 нейтронов (массовое число равно 64). В атоме меди есть четыре энергетических уровня, на которых находятся 29 электронов (рис. 2).
Рис. 2. Строение атома меди.
Электронная формула атома меди в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s1.
Происхождение и нахождение
Гидротермальное. Накапливается в россыпях. Как уникальные явления описаны самородки массой до 450 т.
Самородная медь образуется в восстановительных условиях при различных геологических процессах; значительная часть ее выделяется из гидротермальных растворов. В виде микроскопических выделений наблюдается во многих, преимущественно основных, изверженных породах, подвергшихся воздействию гидротермальных растворов, например, в серпентинизированных перидотитах, дунитах и серпентинитах. В этом случае возникновение самородной меди, возможно, связано с разложением ранее образовавшихся медных сульфидов, например, кубанита (Урал, Закавказье). Аналогичное происхождение можно приписать самородной меди в амфиболитизированных основных породах Серовского района Свердловской области. В Карабашском месторождении медистого золота Челябинской области самородная медь наблюдается в жилообразных телах диопсидо-гранатовых пород, залегающих среди серпентинитов; для самородной меди здесь характерна ассоциация с медистым золотом, халькозином, кальцитом, диопсидом, апатитом, сфеном, магнетитом и др.
В некоторых древних вулканических породах (мелафирах, диабазах и др.), метаморфизованных под воздействием паров, газов и гидротермальных растворов, медь выполняет миндалины, образует цемент между минералами измененной лавы, заполняет пустоты и трещины; сопровождается гидротермальными минералами: анальцимом, ломонтитом, пренитом, датолитом, адуляром, хлоритом, эпидотом, пумпелиитом, кварцем, кальцитом. Крупнейшие месторождения этого типа находятся на полуострове Кивино в районе Верхнего озера (штат Мичиган, США), где оруденение приурочено к верхнепротерозойской толще. Главная масса меди добывается из мелафиров и конгломератов, но наиболее крупные выделения меди (до 400 т и более) встречены в кальцитовых жилах, содержащих самородное серебро и домейкит.
Медный самородок
Запасы, добыча
Глобальные объемы медной руды оцениваются в миллиард тонн (разведанные). Наличие половины подтверждено. Ученые полагают, что земная кора таит еще три миллиарда тонн меденосной руды.
Самородная медь
Богатыми запасами располагают страны на всех континентах:
- Америка – Чили, Канада, США.
- Азия – Казахстан, Иран.
- Африка – ЮАР, Замбия, Заир.
На Россию приходится 3% мировых запасов. Месторождения сосредоточены на Урале. Основной добытчик – концерн «Норильский никель».
Руду добывают открытым либо закрытым способом, в зависимости от глубины залегания.
Ежегодный мировой объем добычи руды – 15-20 млн. тонн.
Методы добычи
Медь добывают открытым и закрытым способом. Первый актуален, если руда находится в толще до 500 метров. Для более глубоких залежей строят специальные подземные шахты. Чистую медь получают в основном пирометаллургическим способом, реже – гидрометаллургическим.
Пирометаллургическая методика условно подразделяется на два этапа, и в качестве исходного сырья использует халькопирит (медный купорос). Первая стадия – флотация или окислительный обжиг. Целью этой технологии является обогащение медной руды, в которой повышена концентрация серы. В процессе обработки, сера удаляется до 1%, другие содержащиеся в руде металлы переводятся в оксидные соединения.
Химические формулы процесса:
- ZnS + 1.5O2 = ZnO + SO2 + Q – реакция протекает при температуре, превышающей +800 градусов;
- ZnS + 2O2 = ZnSO2 + Q – оптимальная температура варьируется в пределах +600/+700 градусов.
После этого, обогащённая руда плавится в шахтных печах при температуре + 14 500 градусов, преобразуясь в сплав, состоящий из сульфидов железа и меди (штейн). Чтобы повысить качество, проводится конвертерный обдув без подачи топлива. Содержание меди в таком сплаве составляет примерно 91%. Вторая стадия – рафинирование, после чего медная составляющая увеличивается до 99.9%.
Гидрометаллургический способ основывается на выщелачивании. Для этого руду дробят на небольшие куски, и заливают растворителями:
- NH4OH;
- H2SO4;
- Fe (SO4).
В результате получается раствор, в котором выделяется медь и другие металлы. Формулы процесса:
- CuO+H2SO4>CuSO4+H2O – выщелачивание серной кислотой;
- CuSO4+2Fe2SO4>4FeSO4+2CuSO+S – применение сульфата железа;
- Cu2S + 2 Fe2 (SО4)3>2 СuSO4 + 4 FeSO4 + S – выщелачивание сернокислым железом.
Полученный раствор проходит последующую обработку для извлечения металла. Например, может использоваться методика цементации: CuSО4 + Fe>FeSО4 + Cu. Здесь в состав добавляются куски железа, заменяющие медную составляющую в сернокислых солях.
Характеристика и особенности
Медь выглядит золотисто-розовым металлом, который при взаимодействии с воздухом приобретает оксидный налёт желтовато-красного оттенка. Так же, как золото, цезий и осмий, характеризуется индивидуальной цветовой окраской. Существуют ещё некоторые особенности металла:
- Обладает высокой степенью электропроводности (после серебра на втором месте), особенно при использовании её в чистом виде. Примесь других металлов или каких-либо веществ в составе снижает её проводимость.
- Металл прочен и долговечен, поэтому широко применяется в производстве труб, кровельных материалов.
- Привлекательный цвет и блеск меди дали возможность использовать её для изготовления посуды, различных декоративных изделий, предметов и украшений интерьера.
- Важной особенностью меди является процесс окисления. При взаимодействии с влажной средой металл приобретает уникальный налёт. Благодаря слою патины металл защищён от коррозионного процесса и различных повреждений. Это свойство меди часто используется художниками и скульпторами. Искусственно подвергая металл воздействию влаги, получают необычную окраску изделия. Примером может служить статуя Свободы в США. С годами на ней стала образовываться патина, и монумент приобрёл зелёный оттенок. Теперь американцы называют свой символ «Зелёная леди».
- Отличается высокой энергоэффективностью. Хорошая теплопроводность металла позволяет значительно экономить энергию. Если система отопления снабжена медными трубами с изоляцией, потери тепла снижаются во много раз. И наоборот, в охладительных системах благодаря металлу поддерживается заданная температура.
- Это незаменимый микроэлемент, участвующий во многих процессах работы организма человека: кроветворении, метаболизме сахара и холестерина, способствует усвоению железа, улучшает работу сердечно-сосудистой системы и головного мозга.
Этим металлом богаты многие продукты. Суточная доза, необходимая для нормального функционирования организма, составляет от 1,5 до 3 мг в сутки. Нужно иметь в виду, что недостаточное количество пагубно влияет на организм человека.
Физические характеристики
Характерный цвет медь приобретает в результате взаимодействия с кислородом и образования тонкой оксидной пленки. Более тонкие пластины на просвет выглядят зеленовато-голубыми. Наиболее ярко выраженные физические свойства меди:
- высокая электро- и теплопроводность (уступает только серебру),
- мягкость,
- пластичность,
- легко поддается вытягиванию и обработке,
- коррозионная стойкость.
Из прочих характеристик меди стоит отметить хорошую невосприимчивость к внешним природным факторам (температура, ультрафиолет, химическое воздействие) и приятный внешний вид (возможность патирования). В случаях, когда необходимо использовать более твердый материал, в ход идут латунь и бронза – сплавы меди с цинком и оловом соответственно. Медная продукция обладают высокой плотностью, может прокатываться в проволоку, пруток или лист любой толщины.
Химические свойства
В условия низкой влажности медь почти не демонстрирует каких-либо особенных химических свойств. Однако при контакте с водой и углекислым газом она быстро вступает в окислительную реакцию, на ее поверхности образуется пленка, защищающая ее от разрушения. Также окисление происходит при нагреве до 375 градусов.
Металл вступает в активную реакцию с неметаллами галогеновой группы, селеном и серой. В паре с последней, к примеру, он воспламеняется. Медь с валентностью I и II участвует в создании комплексных соединений (двойных солей и аммиачных смесей), обладающих высокой стойкостью и применяемых во многих промышленных сферах.
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Возможные степени окисления
Диаграмма Пурбе для меди
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях и комплексах можно получить соединения со степенью окисления +3, +4 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
2Cu+H2O+CO2+O2⟶ (CuOH)2CO3↓{displaystyle {mathsf {2Cu+H_{2}O+CO_{2}+O_{2}longrightarrow (CuOH)_{2}CO_{3}downarrow }}}
Реагирует с концентрированной холодной серной кислотой:
Cu+H2SO4⟶ CuO+SO2↑ +H2O{displaystyle {mathsf {Cu+H_{2}SO_{4}longrightarrow CuO+SO_{2}uparrow +H_{2}O}}}
С концентрированной горячей серной кислотой:
Cu+2H2SO4⟶ CuSO4+SO2↑ +2H2O{displaystyle {mathsf {Cu+2H_{2}SO_{4}longrightarrow CuSO_{4}+SO_{2}uparrow +2H_{2}O}}}
С безводной горячей серной кислотой:
2Cu+2H2SO4 →200oC Cu2SO4↓+SO2↑ +2H2O{displaystyle {mathsf {2Cu+2H_{2}SO_{4} {xrightarrow {200^{o}C}} Cu_{2}SO_{4}downarrow +SO_{2}uparrow +2H_{2}O}}}
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
2Cu+2H2SO4+O2→t∘ 2CuSO4+2H2O{displaystyle {mathsf {2Cu+2H_{2}SO_{4}+O_{2}{xrightarrow {t^{circ }}} 2CuSO_{4}+2H_{2}O}}}
С концентрированной азотной кислотой:
Cu+4HNO3⟶ Cu(NO3)2+2NO2↑+2H2O{displaystyle {mathsf {Cu+4HNO_{3}longrightarrow Cu(NO_{3})_{2}+2NO_{2}uparrow +2H_{2}O}}}
С разбавленной азотной кислотой:
3Cu+8HNO3⟶ 3Cu(NO3)2+2NO↑+4H2O{displaystyle {mathsf {3Cu+8HNO_{3}longrightarrow 3Cu(NO_{3})_{2}+2NOuparrow +4H_{2}O}}}
С «царской водкой»:
3Cu+2HNO3+6HCl⟶ 3CuCl2+2NO↑+4H2O{displaystyle {mathsf {3Cu+2HNO_{3}+6HCllongrightarrow 3CuCl_{2}+2NOuparrow +4H_{2}O}}}
С концентрированной горячей соляной кислотой:
2Cu+4HCl⟶ 2H[CuCl2]+H2↑{displaystyle {mathsf {2Cu+4HCllongrightarrow 2H[CuCl_{2}]+H_{2}uparrow }}}
C разбавленной соляной кислотой в присутствии кислорода:
2Cu+4HCl+O2⟶ 2CuCl2+2H2O{displaystyle {mathsf {2Cu+4HCl+O_{2}longrightarrow 2CuCl_{2}+2H_{2}O}}}
C разбавленной соляной кислотой в присутствии перекиси водорода:
Cu+2HCl+H2O2⟶ CuCl2+2H2O{displaystyle {mathsf {Cu+2HCl+H_{2}O_{2}{}longrightarrow CuCl_{2}+2H_{2}O}}}
С газообразным хлороводородом при 500—600 °C:
2Cu+4HCl+O2 →500−600oC 2CuCl2+2H2O{displaystyle {mathsf {2Cu+4HCl+O_{2} {xrightarrow {500-600^{o}C}} 2CuCl_{2}+2H_{2}O}}}
С бромоводородом:
2Cu+4HBr⟶ 2H[CuBr2]+H2↑{displaystyle {mathsf {2Cu+4HBrlongrightarrow 2H[CuBr_{2}]+H_{2}uparrow }}}
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
2Cu+4CH3COOH+O2⟶ [Cu2(H2O)2(CH3COO)4]{displaystyle {mathsf {2Cu+4CH_{3}COOH+O_{2}longrightarrow [Cu_{2}(H_{2}O)_{2}(CH_{3}COO)_{4}]}}}
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Cu→NH3⋅H2O,O2 [Cu(NH3)2]OH⇄ [Cu(NH3)4](OH)2{displaystyle {mathsf {Cu{xrightarrow {NH_{3}cdot H_{2}O,O_{2}}} [Cu(NH_{3})_{2}]OHrightleftarrows [Cu(NH_{3})_{4}](OH)_{2}}}}
Окисляется до оксида меди(I) при недостатке кислорода при температуре 200 °C и до оксида меди(II) при избытке кислорода при температурах порядка 400—500 °C:
4Cu+O2 →200oC 2Cu2O{displaystyle {mathsf {4Cu+O_{2} {xrightarrow {200^{o}C}} 2Cu_{2}O}}}
2Cu+O2 →400−500oC 2CuO{displaystyle {mathsf {2Cu+O_{2} {xrightarrow {400-500^{o}C}} 2CuO}}}
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
Cu+Cl2⟶ CuCl2{displaystyle {mathsf {Cu+Cl_{2}longrightarrow CuCl_{2}}}}
Cu+Br2⟶ CuBr2{displaystyle {mathsf {Cu+Br_{2}longrightarrow CuBr_{2}}}}
Cu+S →CS2 CuS{displaystyle {mathsf {Cu+S {xrightarrow {CS_{2}}} CuS}}}
С йодом (йодида меди(II) не существует):
2Cu+I2⟶ 2CuI{displaystyle {mathsf {2Cu+I_{2}longrightarrow 2CuI}}}
При 300—400 °C реагирует с серой и селеном:
2Cu+S →300−400oC Cu2S{displaystyle {mathsf {2Cu+S {xrightarrow {300-400^{o}C}} Cu_{2}S}}}
2Cu+Se →300−400oC Cu2Se{displaystyle {mathsf {2Cu+Se {xrightarrow {300-400^{o}C}} Cu_{2}Se}}}
C оксидами неметаллов:
4Cu+SO2 →600−800oC Cu2S+2CuO{displaystyle {mathsf {4Cu+SO_{2} {xrightarrow {600-800^{o}C}} Cu_{2}S+2CuO}}}
2Cu+2NO →500−600oC 2CuO+N2↑{displaystyle {mathsf {2Cu+2NO {xrightarrow {500-600^{o}C}} 2CuO+N_{2}uparrow }}}
4Cu+2NO2 →500−600oC 4CuO+N2↑{displaystyle {mathsf {4Cu+2NO_{2} {xrightarrow {500-600^{o}C}} 4CuO+N_{2}uparrow }}}
Cu+2N2O4 →80oC,CH3−COO−CH2−CH3 Cu(NO3)2+2NO↑{displaystyle {mathsf {Cu+2N_{2}O_{4} {xrightarrow {80^{o}C,CH_{3}-COO-CH_{2}-CH_{3}}} Cu(NO_{3})_{2}+2NOuparrow }}}
С концентрированной соляной кислотой и хлоратом калия:
6Cu+12HCl+KClO3⟶ 6H[CuCl2]+KCl+3H2O{displaystyle {mathsf {6Cu+12HCl+KClO_{3}longrightarrow 6H[CuCl_{2}]+KCl+3H_{2}O}}}
С хлоридом железа(III):
Cu+2FeCl3⟶ CuCl2+2FeCl2{displaystyle {mathsf {Cu+2FeCl3{}longrightarrow CuCl_{2}+2FeCl2{}}}}
Вытесняет менее активные металлы из их солей:
Cu+2AgNO3⟶ Ag+Cu(NO3)2{displaystyle {mathsf {Cu+2AgNO3{}longrightarrow Ag+Cu(NO3{})2{}}}}
Аналитическая химия меди
Возбуждённые атомы меди окрашивают пламя в голубовато-зелёный цвет
Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этом сульфид меди выпадает в далее взвешиваемый осадок.
- В растворах, при отсутствии мешающих ионов, медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Прочие свойства
Очень ковка и тягуча. Электропроводность очень высокая; существенно понижается от примесей.
Поведение при нагревании. Чистая медь плавится при 1083°. Теплопроводность несколько меньше, чем у серебра.
Переработка
Как и алюминий, медь на 100% пригодна для повторного использования без потерь в отношении качества, независимо от того, находится она в сыром состоянии или входит в состав промышленного продукта. По объему медь является третьим наиболее перерабатываемым металлом после железа и алюминия. Подсчитано, что 80% меди, когда-либо добытой, на сегодняшний день используется. Согласно Докладу о запасе металлов в обществе Ресурсной панели ООН, мировой запас меди в использовании на душу населения составляет 35–55 кг. Большая часть приходится на более развитые страны (140–300 кг на душу населения), чем на менее развитые (30–40 кг на душу населения). Процесс переработки меди, проще говоря, аналогичен тому, который используется для извлечения меди, но требует меньшего количества шагов. Лом меди с высокой степенью чистоты плавится в печи и затем восстанавливается и заливается в заготовки и формы; скрап с низкой степенью чистоты рафинируется посредством электролитического разделения в ванне с серной кислотой. 10)
Богатство основного цвета и разнообразие оттенков
До недавнего времени технологические возможности не позволяли сразу получать медь желаемого цвета и крыши домов покрывали классическим желто-блестящим металлом. Со временем, когда на поверхности металла формировался оксид металла, крыша приобретала более темный оттенок. Дальнейшие химические процессы, происходящие в меди, активно взаимодействующей с окружающей средой, приводили к тому, что на ее поверхности образовывался слой патины, имеющей малахитово-зеленый цвет.
Патина, наряду с окраской крыш, надежно защищает их от воздействия коррозии. Медные крыши, покрытые такой пленкой, могут служить десятилетиями, не теряя при этом своих эксплуатационных характеристик.
В наше время с помощью фото в каталогах профильных магазинов сразу можно выбрать, какого цвета листы из меди использовать для покрытия крыши своего дома. Возможности современных технологий позволяют сразу получать медь классического, оксидированного или патинированного типа.
Сейчас медью разного цвета покрывают не только крыши домов, но и их фасадную часть. Следует отметить, что это не только красиво, но и выгодно с финансовой точки зрения. Листы меди, которыми отделан фасад дома, не требуют особого ухода и не выцветают со временем, надежно защищают строительные конструкции от негативного воздействия температурных перепадов и повышенной влажности.
Интересные цвета имеют также оксид и сульфат меди, активно используемые в современной промышленности. Оксид меди, кристаллы которого имеют черный цвет, применяется для придания различных оттенков (синий, зеленый) стеклу и лакокрасочным материалам. Сульфат меди не используется в качестве красителя, но при этом обладает красивым сине-бирюзовым цветом.
Бронзовые слитки
Цвета медных сплавов
Сплавы меди, наиболее известными из которых являются бронза и латунь, имеют схожие с основным металлом цвета.
- Бронза – это сплав меди, основным легирующим элементом в котором является олово. Цвет этого сплава может варьироваться от слегка золотистого до медно-красного. Бронза благодаря своему красивому цвету и простоте в обработке активно используется для изготовления художественных форм и элементов декора, а также для производства изделий, имеющих практическое значение.
- Латунь – сплав меди с цинком. Изделия из латуни имеют красивый золотистый цвет. Кроме красивого цвета, этот сплав обладает исключительной коррозионной устойчивостью, хорошей пластичностью и высокой прочностью, что позволяет использовать его для производства сантехники, деталей для различного оборудования, а также изделий любого другого назначения.
Латунные прутки
Особенности популярных медных сплавов
Сплав М1 изготавливается в соответствии с ГОСТ 859-2014, является высокопластичным и хорошо обрабатываемым металлом, отличается наибольшим содержанием меди (99,9%). В качестве дополнительных элементов встречаются цинк, никель, фосфор, железо, мышьяк, кислород, олово, висмут (суммарно не более 0,1%). Удельное электрическое сопротивление составляет 0,018 мкОм. Сплав может быть двух типов – твердый (М1т) и мягкий (М1м), они различаются по пределам прочности и текучести. Металлопрокат востребован в автомобиле- и авиастроении, при создании проводников тока, криогенной техники, проволоки и прутков.
Сплав М2 имеет меньший коэффициент меди в составе (99,7%). Остальные 0,3% приходятся на никель, железо, сурьму, кислород, олово, свинец, серу, мышьяк. Данная марка пластична и не поддается ржавлению, превосходно обрабатывается под давлением и применяется для изготовления сплавов на медной основе и деталей холодильной техники.
Сплав М3 – это медь техническая, она включает наименьший процент металла среди представленных (99,5%). В качестве легирующих компонентов используются те же элементы, что и в М2, только в большей пропорции (до 0,5%), что делает этот сплав самым доступным по стоимости. Оптимально подходит для металлических изделий, которые реализуются прокатным способом, а также литейных сплавов.
Отличие от других элементов
Химически чистый металл характеризуется тремя особенностями — индивидуальным цветом (с каким медь встречается в быту), пластичностью и стойкостью к коррозии. Последнее свойство формируется благодаря образованию тонкой оксидной плёнки. Этот слой дополняет тёмно-красным оттенком цвет розовой меди, а также придаёт металлу химическую инертность в неагрессивной среде.
Для идентифицирования меди применяется спектральный анализ, требующий специального дорогостоящего приспособления — анализатора металлов, тогда как при самостоятельном анализировании потребуется набор определённых приёмов:
- Визуальное отличие медного лома от других цветных металлов. При естественном освещении чистый элемент Cu имеет красно-розовый цвет. Искусственное освещение меняет цвет меди, бывает ближе к жёлто-зелёному тону.
- Устранение поверхностной оксидной плёнки. Для этого нужно нарушить верхний слой при помощи напильника.
Сложнее будет отличить чистый элемент от медных сплавов: латуни и бронзы, а также омеднённого алюминия. В составе латуни содержатся медь и цинк, наличие которого колеблется от 4 до 45%. При высоком проценте содержания примеси отличить от чистого металла будет несложно, так как цвет латуни будет более светлым.
При возрастании количества цинка в сплаве происходит смещение от красного тона к жёлтому. Следовательно высокомедную латунь с 10% содержанием примесей зрительно можно принять за чистую медь. Однако есть три варианта, благодаря которым можно сделать различие:
- Определение по звуку. При ударе по металлу мягкая медь будет издавать приглушённый звук, а латунь звонкий. Такой метод результативно работает для крупногабаритных изделий, например, труб.
- По сгибу. Её можно легко согнуть, тогда как более жёсткая латунь менее податлива.
- По весу. Плотность Cu 9 г/куб. см. Это выше, чем у цинка (7,1). Латунь характеризуется величиной в среднем 8,6 г/куб. см.
Идентифицировать медь можно также по металлической стружке: медная имеет форму спирали, латунная прямую, игольчатую. Можно использовать химические вещества, например, соляную кислоту. Медь не будет реагировать, находясь в растворе, а поверхность латуни покроется белым налётом, называющимся хлоридом цинка, — результат реакции.
Сферы применения
Наибольшее конечное использование меди как вещества приходится на строительную промышленность. В строительной промышленности широко используются материалы на основе меди.
Области применения меди:
- кровля;
- облицовка;
- системы дождевой воды;
- системы отопления;
- водопроводные трубы и фитинги;
- нефте- и газопроводы;
- электрическая проводка.
Использование меди.
Строительная промышленность является крупнейшим потребителем медных сплавов. Потребление меди по отраслям на ежегодной основе:
- Строительная промышленность — 47%.
- Электронные продукты — 23%.
- Транспортировка — 10%.
- Потребительские товары — 11%.
- Промышленное оборудование — 9%.
Мировое потребление меди и медных сплавов в настоящее время превышает 18 млн тонн в год.
Применение меди встречается при изготовлении:
- линий электропередач;
- архитектурных строений;
- кухонных принадлежностей;
- свечей зажигания;
- электропроводки;
- кабелей и шинопроводов;
- проводов с высокой проводимостью;
- электродов;
- теплообменников;
- холодильных трубок;
- сантехники;
- медных тиглей с водяным охлаждением.