- Метан
- История
- Основные характеристики метана
- Строение
- Физические качества
- Химические свойства
- Откуда берется метан и почему он опасен?
- Метан в природе
- Метан и парниковый эффект
- Формула метана и способы его получения
- Применение метана
- Метан с кислородом: реакция горения
- Особенности сгорания метана
- При какой температуре горит метан?
- Разложение метана
- Как получить ацетилен
- Получение в промышленности
- Как осуществляется крекинг
- Радикальный механизм хлорирования метана
- Закономерности радикального хлорирования метана
- Ионный механизм хлорирования метана
- Особенности хлорирования метана
- Где используется процесс
Метан
- Мета́н (лат. methanum), CH4 — простейший по составу предельный углеводород, бесцветный газ (в нормальных условиях) без запаха. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно тиолы) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека.
Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему.
Накапливаясь в закрытом помещении, метан становится взрывоопасен. Обогащают одорантами, чтобы человек вовремя заметил утечку газа. На промышленных производствах утечки фиксируют датчики, и во многих случаях метан для лабораторий и промышленных производств поставляется без добавления одорантов.
Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %. Наиболее взрывоопасная концентрация 9,5 %. Проявляет наркотические свойства; наркотическое действие ослабляется малой растворимостью в воде и крови. Класс опасности — четвёртый.
Метан — третий по значимости (4 — 9 %) парниковый газ в атмосфере Земли (после водяного пара и углекислого газа).
История
В ноябре 1776 года итальянский физик Алессандро Вольта обнаружил метан в болотах озера Лаго-Маджоре на границе Италии и Швейцарии. На изучение болотного газа его вдохновила статья Бенджамина Франклина о «горючем воздухе». Вольта собирал газ, выделяемый со дна болота, и в 1778 году выделил чистый метан. Также он продемонстрировал зажигание газа от электрической искры.
Сэр Гемфри Дэви в 1813 году изучал рудничный газ и показал, что он является смесью метана с небольшими количествами азота N2 и углекислого газа CO2 — то есть, что он качественно тождествен по составу болотному газу.
Современное название «метан» в 1866 году газу дал немецкий химик Август Вильгельм фон Гофман [13] [14] , оно образовано от слова «метанол».
Основные характеристики метана
Метан — самый простой представитель алканов. Эту группу органических соединений называют предельными, насыщенными или парафиновыми углеводородами. Они имеют простую связь между атомами углерода в молекуле, остальные валентности каждого углеродного атома насыщены атомами водорода. Самая важная реакция алканов — горение. Горят алканы с образованием паров воды и газообразной двуокиси углерода. В результате этой реакции в огромных количествах выделяется химическая энергия, которую можно преобразовать в электрическую или тепловую.
Молекула метана
Горение метана используется для получения горячих дымовых газов, энергия которых обеспечивает работу газовой турбины. Во многих населенных пунктах метан подается по трубам в дома и используется для внутреннего отопления и приготовления пищи. Если сравнивать с другими видами углеводородного топлива, сжигание природного газа (метана) характеризуется меньшим выделением углекислого газа и большим количеством выделяемого тепла. Здесь вы найдете интересные эксперименты для изучения различных газов.
Система отопления
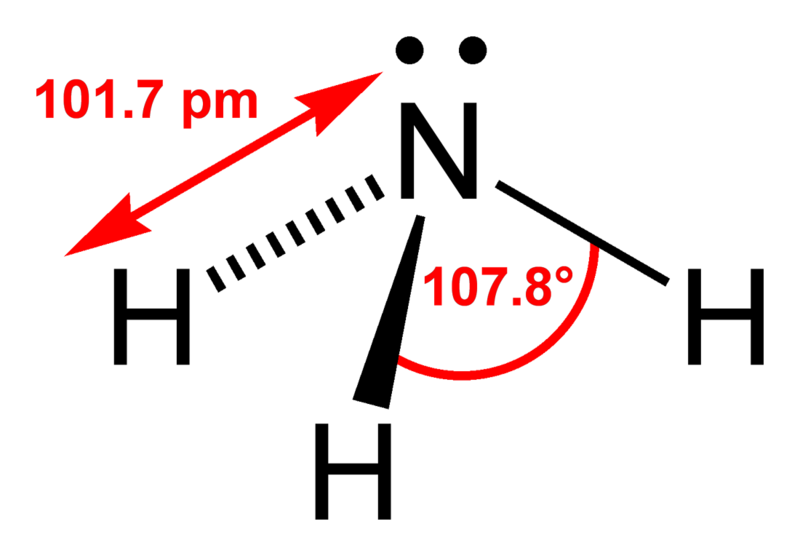
Строение
Молекула метана представляет собой тетраэдр, в середине которого находится углерод, соединённый простыми (одинарными) σ-связями с атомами водорода. Строение и свойства молекулы метана важны для понимания всей органической химии, так как большинство органических соединений содержит метильные группы -СН2.
Рис. 1. Строение молекулы метана.
Метан образует гомологический ряд алканов. Каждый последующий гомолог отличается от предыдущего на одну группу -СН2.
Из-за тетраэдрической конфигурации длинные молекулы алканов имеют вид изогнутых цепочек.
Физические качества
Метан представляет собой самый простой углеводород. Считается, что он имеет специфический запах, но это распространённое заблуждение. Чистый газ не имеет запаха, характерный аромат он приобретает благодаря специальным добавкам, которые добавляют в вещество для предупреждения о его утечке, ведь цвета химическое соединение также не имеет.
Кроме того, к физическим свойствам метана относятся:
- Горение голубым пламенем.
- Сгорание без выделения вредных продуктов.
- Плохая растворимость в воде.
- Он легче воздуха.
- Основная составляющая природных, попутных нефтяных, рудничного и болотного газов.
- Кипение при температуре -161 °C.
- Замерзание при температуре -183 °C.
- Молярная масса составляет 16,044 г/моль.
- Плотность — 0,656 кг/м³.
- При соединении с воздухом образуются взрывоопасные смеси.
- В жидком виде представляет собой бесцветную жидкость без запаха.
Наиболее опасен метан, который выделяется во время подземных разработок полезных ископаемых, а также на фабриках, занимающихся переработкой и обогащением угля. Когда количество газа в воздухе достигает 5−6%, то он начинает гореть рядом с источниками тепла.
Если уровень вещества поднимается до 14−16%, то может произойти взрыв. При увеличении концентрации вещество горит при постоянном поступлении кислорода. Если же в этот момент количество метана начнёт снижаться, то результатом также может стать взрыв. При взрыве огонь, подпитываемый газом, движется со скоростью от 500 до 700 м/сек. Давление же вещества в этот момент в замкнутом пространстве составляет 1 Мн/м2.
При соприкосновении с источником тепла метан воспламеняется с небольшой задержкой. Это свойство вещества применяется при изготовлении предохранительных взрывчатых веществ и электрооборудования, безопасного при взрывах. На всех объектах, где существует опасность выброса метана, действуют правила техники безопасности «газовый режим».
Химические свойства
В химии формула метана — CH4. Соединение плохо вступает в химические связи.
В обычных условиях оно не реагирует со следующими веществами:
- концентрированные кислоты;
- расплавленные и концентрированные щелочи;
- щелочные металлические реагенты;
- галогены;
- перманганат калия;
- дихромат калия в кислой среде.
При температуре около 200 °C и давлении от 30 до 90 атмосфер болотный газ окисляется, преобразуясь в муравьиную кислоту. Вещество образует соединения, называемые газовыми гидратами, которые часто встречаются в природе.
По своим химическим свойствам метан схож с другими реагентами, относящимися к алканам. А потому он вступает в такие химические реакции, как:
- Конверсия в синтез-газ. Синтез-газ, который образуется в результате указанной реакции, используется для получения метанола, углеводородов и так далее.
- Галогенирование. Такая реакция является цепной. При ней молекула брома или йода подвергается воздействию света и распадается на радикалы, которое затем атакуют молекулы метана. В результате от соединения отрывается атом водорода, а газ становится свободным метилом CH3. Получившееся вещество сталкивается с молекулами брома или йода, которые разрушаются, образуя новые радикалы этих реагентов.
- Нитрование.
- Окисление или горение. Эта реакция происходит при избытке кислорода и описывается следующим уравнением: CH4 + 2O2 → CO2 + 2H2O. В этом случае пламя имеет голубой цвет. Если кислорода недостаточно, то результатом реакции становится выработка не углекислого газа, а оксида углерода. Если же кислорода ещё меньше, то взаимодействие веществ приведёт к выделению мелкодисперсного углерода.
- Сульфохлорирование.
- Сульфоокисление.
- Разложение.
- Дегидрирование.
- Каталитическое окисление. В подобных реакциях из болотного газа образуются карбоновые кислоты, спирты, альдегиды.
Откуда берется метан и почему он опасен?
В 2018 году на метан (CH4) около 9,5% всех выбросов парниковых газов в США приходилось на результаты деятельности человека. Деятельность человека в вопросе выбросов метана включает в себя утечки из систем добычи природного газа и разведение домашнего скота. Метан также выделяется из природных источников, таких как естественные водно-болотные угодья. Кроме того, естественные процессы в почве и химические реакции в атмосфере помогают удалить CH4 из атмосферы. Время жизни метана в атмосфере намного короче, чем у диоксида углерода (CO2 ), но CH4 более эффективно улавливает излучение. Сравнительное воздействие CH4 в 25 раз больше, чем CO2 за 100-летний период.
Во всем мире от 50 до 65% общих выбросов CH4 приходится на деятельность человека.
- Сельское хозяйство. Домашний скот — крупный рогатый скот, свиньи, овцы и козы — вырабатывает метан как часть нормального процесса пищеварения. Кроме того, это газ образуется при хранении или обработке навоза. Поскольку люди выращивают этих животных для еды и других продуктов, выбросы считаются связанными с деятельностью человека. При объединении выбросов домашнего скота и навоза сельскохозяйственный сектор является крупнейшим источником выбросов метана.
- Энергетика и промышленность. Системы природного газа и нефти являются вторым по величине источником выбросов метана. Этот газ — основной компонент природного газа В США. Метан выбрасывается в атмосферу при производстве, переработке, хранении, транспортировке и распределении природного газа, а также при производстве, переработке, транспортировке и хранении сырой нефти. Добыча угля также является источником выбросов CH4.
- Отходы домов и предприятий. Метан образуется на свалках при разложении отходов и при очистке сточных вод. Свалки являются третьим по величине источником выбросов CH4 в США. Метан также образуется при очистке бытовых и промышленных сточных вод и при компостировании.
Метан, кроме того, выделяется из ряда природных источников. Природные водно-болотные угодья являются крупнейшим источником выбросов CH4 от бактерий, разлагающих органические материалы в отсутствие кислорода. Меньшие источники включают термиты, океаны, отложения, вулканы и лесные пожары.
Метан в природе
В естественных условиях метан имеет несколько источников:
- природный газ и попутные нефтяные газы, в составе которых метан является главным компонентом;
- рудничный газ, поступающий из угольных пластов и образующий с воздухом взрывоопасную смесь;
- вулканические газы;
- продукты обмена веществ некоторых анаэробных микроорганизмов, перерабатывающих клетчатку и обитающих в болотах, стоячих водоемах, в пищеварительном тракте жвачных животных.
Метан способен в больших количествах накапливаться в газогидратной форме в многолетней мерзлоте и на океанском дне. В составе метангидрата молекула внедряется в полости внутри кристаллической решетки водяного льда. Соединения с такой структурой называют клатратами. При таянии льда газ высвобождается и поступает в атмосферу.
За пределами Земли метан в большом количестве обнаружен на спутнике Сатурна Титане, в атмосферах планет-гигантов и Марса.
Метан и парниковый эффект
Метан является парниковым газом. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 23 единицы. Содержание в атмосфере метана росло очень быстро на протяжении последних двух столетий.
Сейчас среднее содержание метана CH4 в современной атмосфере оценивается как 1,8 ppm (parts per million, частей на миллион). И, хотя это в 200 раз меньше, чем содержание в ней углекислого газа (CO2), в расчете на одну молекулу газа парниковый эффект от метана — то есть его вклад в рассеивание и удержание тепла, излучаемого нагретой солнцем Землей — существенно выше, чем от СО2. Кроме того, метан поглощает излучение Земли в тех «окошках» спектра, которые оказываются прозрачными для других парниковых газов. Без парниковых газов — СO2, паров воды, метана и некоторых других примесей средняя температура на поверхности Земли была бы всего –23°C , а сейчас она около +15°C.
Метан высачивается на дне океана через трещины земной коры, выделяется в немалом количестве при горных разработках и при сжигании лесов. Недавно обнаружен новый, совершенно неожиданный источник метана — высшие растения, но механизмы образования и значение данного процесса для самих растений пока не выяснены.
.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
СH4 | Н | Н — С — Н | Н |
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.
Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.
В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.
Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.
Оцените материал(4.14) Поделиться
Метан с кислородом: реакция горения
Процесс горения метана — это взаимодействие метана с кислородом. В результате реакции образуется вода, двуокись углерода и много энергии. Уравнение реакции горения метана:
CH₄[газ] + 2O₂[газ] → CO₂[газ] + 2H₂O[пар] + 891кДж
Описание реакции
1 молекула метана при взаимодействии с 2 молекулами кислорода образует 1 молекулу двуокиси углерода и 2 молекулы воды. В процессе реакции выделяется тепловая энергия, равная 891 кДж.
Природный газ — самое чистое для сжигания ископаемое, имеющее простой состав и не выделяющее в воздух вредных химических веществ. Так как природный газ на 95% состоит из метана, то при его сжигании побочные продукты почти не образуются, или их образуется намного меньше, чем при использовании других видов ископаемого топлива.
Природный газ горит практически без копоти [Flickr]
Если внести в пламя метана фарфоровую крышку от тигля, она не закоптится, так как входящий в состав метана углерод сгорает полностью. Некоптящее пламя — это качественная реакция на предельные углеводороды.
Особенности сгорания метана
Метан может выделяться из пластов горных пород постоянно или кратковременно. Кратковременное появление представляет собой выброс из зоны скопления при возникновении трещин и разломов в пласте. Помимо выделения газа, происходит выброс угля и обломков горных пород. Кратковременное выделение газа опасно для жизни человека из-за быстрого увеличения его количества, которое при достижении в метановоздушной смеси концентрации метана 5 % приводит к взрыву.
Для полного сгорания каждого 1 м3 газа в условиях топки понадобится около 2 м3 кислорода. Взаимодействие с окислителем допускается в условиях атмосферного воздуха. Если объем кислорода составляет 21 %, то для полного сгорания нужно 4,76 раз больше атмосферного воздуха, чем чистого кислорода. Процесс горения метана требует постоянного контроля поступления кислорода в топку. Для этого отбирают пробы продуктов горения на определение их состава в процентном соотношении.
При какой температуре горит метан?
Сжигание метана используется для получения тепловой энергии. Данное химическое соединение является взрывоопасным. При попадании в зону открытого пламени оно взрывается, но в условиях обычной температуры даже при достаточной концентрации газа в воздухе горение не происходит. Температура горения метана составляет 537 ⁰С при самовоспламенении, 187 ⁰С – при вспышке. Воспламенение с взрывом возможно, если его концентрация достигает не менее 5 %. Горение метана происходит при концентрации его от 14 %, взрыв не происходит. Температура плавления данного химического соединения составляет 182 ⁰С.
Интересный факт! Ученые выявили наличие залежей гидрата метана на океаническом шельфе Карского моря в местах вечной мерзлоты. Это вещество внешне похоже на утрамбованный снег. Оно представляет собой соединение воды с метаном. Гидрат метана абсолютно инертен при постоянной температуре, но способен воспламеняться при ее повышении. При изменении давления химическое соединение распадается на воду и метан. Из 1 см3 гидрата метана образуется 180 см3 чистого газа.
Разложение метана
Разложение метана (также называемое пиролизом метана или крекингом метана) — это химический процесс, разделяющий метан или, в общем, углеводороды на его элементарные компоненты — водород и твердый углерод (уравнение (1) ). Основная реакция эндотермическая; необходимая энергия может поступать из разных источников энергии.
Метан входит, а водород выходит из этого процесса разложения как в газообразном состоянии, а углерод в твердом состоянии. Кислород в этом процессе вообще не участвует (т.е. CO или CO2 не образуются). Таким образом, для облагораживания продуктового газа нет необходимости в дополнительном отделении CO или CO2 . Следовательно, этот процесс менее сложен, чем, например, «классический» процесс паровой конверсии метана (SMR) [27] , [28] . В зависимости от требуемой чистоты водорода и степени конверсии водорода такие процессы могут работать без какой-либо дополнительной очистки или повышения качества газа. Это может иметь место, если произведенный водород используется исключительно в качестве газа для сжигания, как это реализуется на заводе, расположенном в Небраске ( Таблица 2). Если необходима высокая чистота получаемого водорода, необходима последующая стадия разделения водорода и метана.
Если желаемым продуктом является только водород без углерода, теоретическая эффективность процесса составляет 59% (уравнение (2) ). Оставшаяся энергия, изначально содержащаяся в природном газе, сохраняется в виде углерода. В реальных приложениях КПД ниже, например, из-за тепловых потерь. Стехиометрически, 21 кг твердого углерода производится на 1 ГДж водорода (в этой статье в качестве эталона используется более высшая теплотворная способность (HHV)).
На рис. 2 показаны три категории систем непрерывного разложения метана, которые различаются в зависимости от типа реактора, использования катализатора и источника энергии, связанной с процессом. Большинство возможных комбинаций типа реактора, катализатора и источника энергии можно найти в литературе. Статус технологического развития охватывает все стадии от передовых НИОКР до коммерчески доступных процессов. Однако ни один из этих коммерчески доступных процессов не производит углерод и водород высокой чистоты в качестве источника энергии (таблица2).
Как получить ацетилен
Из метана в домашних условиях получить ацетилен очень сложно. Самый простой метод выделения данного газа – это реакция воды с карбидом кальция. Многие из вас, наверное, помнят, как бросали в лужи кусочки этого вещества и какая происходила реакция. При этом отмечалось бурное шипение. Что касается карбида кальция, то он постепенно таял, образовывая большое количество пены. Подобную реакцию можно записать так:
СаС2+2Н2О=С2Н2+Са(ОН)2.
Многие используют технический карбид кальция, который содержит большое количество примесей. В результате этого при реакции с водой вещество выделяет неприятный запах. Возникает он из-за образования вместе с ацетиленом незначительного количества паров ядовитых газов. Чаще всего это фосфин, сероводород и так далее. Этот способ считается самым распространенным, так как получить ацетилен из метана можно только при помощи специального оборудования.
Получение в промышленности
Как получают ацетилен из метана в промышленных условиях? В настоящее время применяется только один метод – крекинг. В процессе получения ацетилена осуществляется разрыв связей -С-С. Происходит это в присутствии катализаторов и при воздействии достаточно высоких температур. Для получения используется метан – природный газ. Это недорогое и легкодоступное сырье. Именно по этой причине крекинг является наиболее обоснованным методом как в экономическом плане, так и в техническом.
Как осуществляется крекинг
Осуществить превращения «метан — ацетилен» можно несколькими способами. В первом случае природный газ пропускают через предварительно раскаленные электроды. При этом температура может доходить до 1600 °С. После нагрева происходит быстрое охлаждение. Второй способ основан на использовании тепла, которое образуется в результате частичного сгорания ацетилена.
Уравнения реакций «метан — ацетилен» записываются следующим образом:
- В I случае: 2СН4 = С2Н2 + 3Н2.
- Во II случае: 6СН4 + 4О2 = С2Н2 + 8Н2 + 3СО + СО2 + 3Н2О.
Специалисты не рекомендуют использовать для хранения ацетилена баллоны, оснащенные вентилями из бронзы. Ведь в состав этого сплава входит медь. Так как ацетилен химически активен, он может вступить в реакцию с металлом. В результате этого образуются взрывоопасные соли.
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
- зарождение цепи (инициирование)
Рисунок 3. Хлорирование метана
- рост цепи
Рисунок 4. Хлорирование метана
- обрыв цепи (рекомбинация)
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 000$ и более.
На рис. 6 показана энергетическая диаграмма хлорирования метана.
Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи — связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой ${rm H}-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах — плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
Ионный механизм хлорирования метана
В присутствии катализаторов ( кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Особенности хлорирования метана
Характерное свойство алканов — вступать в реакцию с таким представителем группы галогенов, как хлор. Метан не является исключением.
В хлорировании метана есть свои особенности:
- для распада хлорной молекулы на атомы используют ультрафиолет;
- в процессе хлорирования метана выделяется теплота в количестве 108,8 кДж/моль;
- хлорирование алканов происходит при рассеянном свете, потому что при прямом освещении возможен взрыв;
- хлорирование метана происходит либо с подогревом до 200 градусов Цельсия, либо при ультрафиолетовом свете.
В ходе реакции хлорирования происходит замещение в формуле алканов атомов водорода атомами хлора. В результате получаются хлорпроизводные насыщенные углеводороды. В зависимости от мольного соотношения хлора и метана получают:
- при реакции 2 молей хлора с 1 молем метана — в основном хлористый метил, хлористый метилен и хлороформ;
- при соотношении хлор/метан два к четырем главными продуктами являются хлороформ и четыреххлористый углерод.
Где используется процесс
Хлорпроизводные насыщенные углероды, получаемые в процессе хлорирования метана, используются в различных сферах человеческой деятельности.
Прежде всего продукты хлорирования метана являются хорошими растворителями. Пример такого растворителя — (CH_{2}Cl_{2}), дихлорметан.
Хлористый метил применяют при производстве метилцеллюлозы, в качестве хладагента для холодильных установок. Также он используется как производное для получения пластмасс и каучуков.
Тетрахлорметан (CСl_{4}) применяется для тушения пожаров. Хлороформ (CHCl_{3}) — в медицине в качестве анестетика.