- История
- Современное определение
- Основание в теории Брёнстеда — Лоури
- Основание в теории Льюиса
- Основание в общей теории Усановича
- Номенклатура оснований
- Тривиальные названия некоторых оснований
- Классификация оснований
- По растворимости в воде
- По числу гидроксогрупп
- Сила оснований
- Количественное описание силы оснований
- Физические свойства оснований
- Химические свойства оснований
- Взаимодействие с кислотами
- Взаимодействие оснований с амфотерными оксидами и гидроксидами
- Взаимодействие с кислотными оксидами
- Взаимодействие оснований с солями
- Растворы щелочей изменяют окраску индикатора
- Термическое разложение
- Получение оснований
- Взаимодействие металла с водой
- Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
- Электролиз
- Получение нерастворимых оснований при взаимодействии соли со щелочью
- Применение
- Разница между сильными и слабыми основаниями
- Определение
- Диссоциация
- pH
- ПКБ
- Реактивность
- Резюме
История
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (например, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами. Руэль предположил, что эти вещества служат «основаниями» для образования солей в твёрдой форме.
Единая теория кислот и оснований была впервые представлена шведским физикохимиком С. Аррениусом в 1887 году. В рамках своей теории Аррениус определял кислоту как вещество, при диссоциации которого образуются протоны H+, а основание — как вещество, дающее при диссоциации гидроксид-ионы OH−. Теория Аррениуса, однако, имела свои недостатки — например, она не учитывала влияние растворителя на кислотно-основное равновесие, а также была неприменима к неводным растворам.
В 1924 году Э. Франклином была создана сольвентная теория, согласно которой основание определялось как соединение, которое при диссоциации увеличивает число тех же анионов, которые образуются при диссоциации растворителя.
Современное определение
С 1923 года основание стали определять в рамках теорий Брёнстеда — Лоури и Льюиса, которые широко применяются и в настоящее время.
Основание в теории Брёнстеда — Лоури
В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Й. Брёнстедом и английским учёным Т. Лоури, основанием Брёнстеда называется соединение или ион, способный принимать (отщеплять) протон от кислоты. Соответственно, кислота Брёнстеда является донором протонов, а взаимодействие кислоты с основанием сводится к передаче протона. При реакции основания Брёнстеда B с кислотой, например, с водой, основание превращается в сопряжённую кислоту BH+, а кислота становится сопряжённым основанием.
Основание в теории Льюиса
Кислота Льюиса (А) является акцептором электронной пары основания Льюиса (В) и образует с ним ковалентную связь
Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Льюисом, основание — это вещество, способное отдавать электронную пару на образование связи с кислотой Льюиса. Основаниями Льюиса могут быть амины R3N, спирты ROH, простые эфиры ROR, тиолы RSH, тиоэфиры RSR, анионы, соединения с π-связями. В зависимости от орбитали, на которой расположена участвующая в реакции пара электронов, основания Льюиса подразделяют на n-, σ- и π-типы — электронные пары для этих типов расположены соответственно на несвязывающих, σ- и π-орбиталях.
Понятия основания в теориях Льюиса и Брёнстеда — Лоури совпадают: согласно обеим теориям основания отдают пару электронов на образование связи. Разница заключается лишь в том, куда расходуется эта электронная пара. Основания Брёнстеда за её счёт образуют связь с протоном, а основания Льюиса — с любыми частицами, имеющими вакантную орбиталь. Таким образом, существенные различия этих теорий касаются понятия кислоты, а не основания.
Теория Льюиса не предусматривает количественной оценки способности оснований реагировать с кислотами Льюиса. Однако, для качественной оценки широко применяется принцип жёстких и мягких кислот и оснований Пирсона (принцип ЖМКО), согласно которому жёсткие кислоты предпочтительно реагируют с жёсткими основаниями, а мягкие кислоты — с мягкими основаниями. По Пирсону, жёсткими основаниями являются основания, донорный центр которых обладает низкой поляризуемостью и высокой электроотрицательностью. Напротив, мягкими основаниями являются донорные частицы с высокой поляризуемостью и низкой электроотрицательностью. Жёсткие и мягкие кислоты обладают такими же свойствами как жёсткие и мягкие основания соответственно с той разницей, что они являются акцепторными частицами.
Классификация оснований и кислот в рамках принципа ЖМКОЖёсткие основания Промежуточные основания Мягкие основанияЖёсткие кислоты Промежуточные кислоты Мягкие кислоты
| OH−, RO−, F−, Cl−, RCOO−, NO3−, NH3, RNH2, H2O, ROH, SO42−, CO32−, R2O, NR2−, NH2− | Br−, C6H5NH2, NO2−, C5H5N | RS−, RSH, I−, H−, R3C−, алкены, C6H6, R3P, (RO)3P |
| H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Fe3+, BF3, B(OR)3, AlR3, AlCl3, SO3, BF3, RCO+, CO2, RSO2+ | Cu2+, Fe2+, Zn2+, SO2, R3C+, C6H5+, NO+ | Ag+, Cu+, Hg2+, RS+, I+, Br+, Pb2+, BH3, карбены |
Критерий ЖМКО не имеет количественных параметров, однако основания Льюиса можно приблизительно расположить в ряды по их льюисовской основности.
Основание в общей теории Усановича
В общей теории кислот и оснований, созданной М. И. Усановичем в 1939 году, основание определено как вещество, отдающее анионы (или электроны) и принимающие катионы. Таким образом, в рамках теории Усановича в понятие основания входят как основания Брёнстеда, так и основания Льюиса, а также восстановители. Кроме того, само понятие основности, как и кислотности, в общей теории Усановича рассматривается как функция вещества, проявление которой зависит не от самого вещества, а от его партнёра по реакции.
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Существует также основание NH4OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH4+.
Тривиальные названия некоторых оснований
ФормулаНазвание
| KOH | Едкое кали |
| NaOH | Едкий натр, каустическая сода |
| Ca(OH)2 | Гашеная известь |
| Ca(OH)2 (прозрачный раствор) | Известковая вода |
| Ca(OH)2 (мутный раствор) | Известковое молоко |
| Ba(OH)2 | Едкий барит |
Классификация оснований
По растворимости в воде
В зависимости от растворимости в воде выделяют:
- щелочи. Эти основания растворимы в воде: NaOH, KOH, Ba(OH)2 и другие. Ca(OH)2, хотя малорастворим, тоже относится к щелочам из-за своей едкости;
- нерастворимые основания. К таким основаниям относятся Fe(OH)2, Cu(OH)2 и другие;
- амфотерные гидроксиды. К амфотерным относятся те основания, которые образованы металлами со степенью окисления +3 или +4. Эти основания отличаются тем, что проявляют как основные свойства, так и кислотные.Также есть основания, которые относятся к амфотерным, но образованы металлом с иной степенью окисления: Zn(OH)2, Pb(OH)2, Sn(OH)2, Be(OH)2.
Напомним, что растворимость мы проверяем по таблице растворимости кислот и оснований в воде.
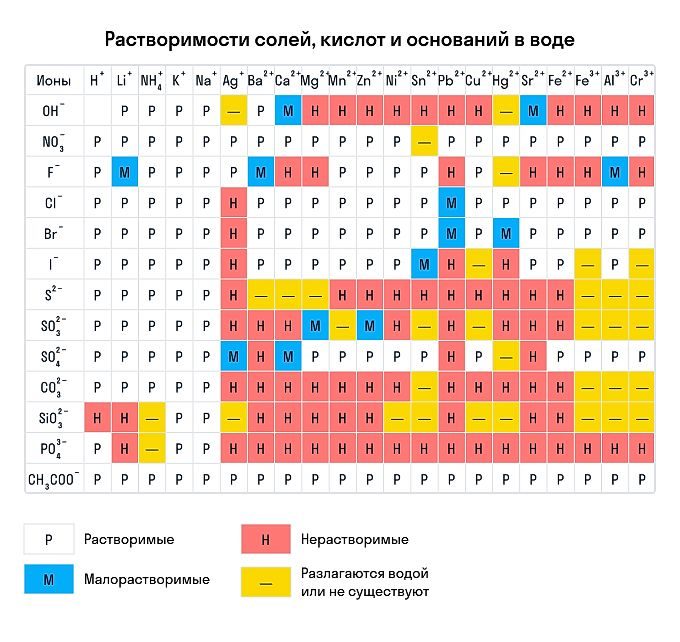
По числу гидроксогрупп
В зависимости от количества гидроксильных групп, способных замещаться на кислотный остаток, выделяют следующие виды оснований:
- однокислотные: KOH, NaOH;
- двухкислотные: Fe(OH)2, Ba(OH)2;
- трехкислотные: Al(OH)3, Fe(OH)3.
Сила оснований
Количественное описание силы оснований
Теория Брёнстеда — Лоури позволяет количественно оценить силу оснований, то есть их способность отщеплять протон от кислот. Это принято делать при помощи константы основности Kb — константы равновесия реакции основания с кислотой сравнения, в качестве которой выбрана вода. Чем выше константа основности, тем выше сила основания и тем больше его способность отщеплять протон. Часто константу основности выражают в виде показателя константы основности pKb.
Для многоосновных оснований используют несколько значений констант диссоциации Kb1, Kb2 и т. д. Например, фосфат-ион может протонироваться трижды.
Например, вода является слабой кислотой и при отщеплении протона превращается в сильное основание — гидроксид-ион OH−.
Значения pKb некоторых оснований и pKa их сопряжённых кислот в разбавленных водных растворах
Формула основанияФормула сопряжённой кислотыpKbpKa (BH+)Формула основанияФормула сопряжённой кислотыpKbpKa (BH+)
| ClO4− | HClO4 | 19 ± 0,5 | −5 ± 0,5 | HPO42− | H2PO4− | 6,80 | 7,20 |
| HSO4− | H2SO4 | 16,8 ± 0,5 | −2,8 ± 0,5 | ClO− | HClO | 6,75 | 7,25 |
| H2O | H3O+ | 15,74 | −1,74 | H2BO3− | H3BO3 | 4,76 | 9,24 |
| NO3− | HNO3 | 15,32 | −1,32 | NH3 | NH4+ | 4,75 | 9,25 |
| HOOC-COO− | (COOH)2 | 12,74 | 1,26 | CN− | HCN | 4,78 | 9,22 |
| HSO3− | H2SO3 | 12,08 | 1,92 | CO32− | HCO3− | 3,67 | 10,33 |
| SO42− | HSO4− | 12,04 | 1,96 | HOO− | H2O2 | 11,62 | 3,38 |
| H2PO4− | H3PO4 | 11,88 | 2,12 | PO43− | HPO42− | 1,68 | 12,32 |
| F− | HF | 10,86 | 3,14 | OH− | H2O | −1,74 | 15,74 |
| NO2− | HNO2 | 10,65 | 3,35 | NH2− | NH3 (ж.) | −19 | 33 |
| CH3COO− | CH3COOH | 9,24 | 4,76 | H− | H2 | −24,6 | 38,6 |
| SH− | H2S | 6,95 | 7,05 | СH3− | СH4 | ~−44 | ~58 |
Физические свойства оснований
Основания при обычных условиях — это твердые кристаллические вещества без запаха, нелетучие, чаще всего белого цвета. В таблице приведены основания, которые имеют иную окраску.
Цвет основанияПримеры
| Белый |
|
| Желтый | Гидроксид меди (I) CuOH |
| Светло-розовый (при соприкосновении с кислородом воздуха — коричневый) | Гидроксид марганца (II) Mn(OH)2 |
| Красно-коричневый | Гидроксид железа (III) Fe(OH)3 |
| Белый с зеленоватым оттенком (темнеет при соприкосновении с кислородом воздуха) | Гидроксид железа (II) Fe(OH)2 |
| Светло-зеленый | Гидроксид никеля (II) Ni(OH)2 |
| Синий | Гидроксид меди (II) Cu(OH)2 |
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие с кислотами
В результате реакции между щелочью и кислотой образуется раствор соли, в котором уже нет ни щелочи, ни кислоты. Такой раствор называется нейтральным. Слово «нейтральный» происходит от греческого «нейтер», что в переводе на русский язык означает «ни тот ни другой».
Напомним, что реакция между щелочью и кислотой, в результате которой образуется нейтральный раствор, называется реакцией нейтрализации.
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6].
Взаимодействие с кислотными оксидами
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид P2О5, которому соответствует кислота H3PO4 (указана в квадратных cкобках), то в составе образующейся соли будет остаток этой кислоты — PO4 с валентностью, равной III.
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции.
Растворы щелочей изменяют окраску индикатора
Гидроксид-ионы, которые содержатся в растворе щелочи, взаимодействуют с индикатором, образуя новые соединения. Признак реакции — окраска раствора.

Термическое разложение
Все нерастворимые основания при нагревании разлагаются по общей схеме:
Краткие выводы:
- Основания делятся на растворимые в воде (щелочи) и нерастворимые.
- Все основания реагируют с кислотами. Растворимые основания реагируют с кислотными оксидами и солями. Нерастворимые основания подвергаются термическому разложению.
Получение оснований
Взаимодействие металла с водой
Активные металлы (металлы групп IA и IIA, кроме Be и Mg) активно взаимодействуют с водой при обычных условиях с образованием щелочей.
Нерастворимые основания данным способом получить невозможно, за исключением Mg(OH)2.
Металл + вода = гидроксид металла + водород
Например: Na + H2O = NaOH + H2↑
Гидроксид магния можно получить данным способом, но только при нагревании.
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
Этим способом получают только растворимые в воде основания.
Оксид металла + вода = щелочь
Например: CaO + H2O = Ca(OH)2
Электролиз
Гидроксид натрия и калия в промышленности получают с помощью электролиза — через раствор хлорида калия проводят постоянный электрический ток:
KCl + H2O = KOH + H2↑ + Cl2↑
Электролиз хлорида натрия протекает по аналогичной схеме.
Получение нерастворимых оснований при взаимодействии соли со щелочью
Растворимая соль + щелочь = нерастворимое основание + другая соль
Например: Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3
Применение
Физико-химические свойства оснований сделали их незаменимыми веществами во всех отраслях, использующих химические технологии:
- в добыче полезных ископаемых и металлургии;
- в производстве потребительских товаров, косметической, пищевой и фармацевтической продукции;
- в производстве красителей, бытовой химии и удобрений;
- в топливной и химической промышленности;
- в строительстве и многих других областях.
Наиболее широко применяются щелочи, но и нерастворимые основания используются в производстве полимеров, в очистных сооружениях, в медицине, в электротехнике.
Разница между сильными и слабыми основаниями
Определение
Сильные основания: Сильное основание — это соединение, которое может полностью диссоциировать на катион и гидроксильный ион в водном растворе.
Слабые базы: Слабое основание — это соединение, которое частично диссоциирует на гидроксильный ион и катион, создавая условия равновесия.
Диссоциация
Сильные основания: Сильные основания диссоциируют на ионы почти на 100%.
Слабые базы: Слабые основания частично диссоциируют на ионы.
pH
Сильные основания: Значение pH ближе к 14 указывает на сильное основание.
Слабые базы: Значение pH ближе к 7, но выше 7 указывает на слабое основание.
ПКБ
Сильные основания: Значение pKb для сильных оснований почти равно нулю или очень низкое значение.
Слабые базы: Значение pKb для слабых оснований очень высоко.
Реактивность
Сильные основания: Сильные основания очень реактивны.
Слабые базы: Слабые основания менее реактивны по сравнению с сильными основаниями.
Резюме
Основания — класс неорганических веществ, нашедший своё применение с давних времен. За счет наличия гидроксогруппы обладает особыми химическими свойствами. Основания позволяют рассмотреть особенности поведения других классов неорганических соединений, таких как кислотные и амфотерные оксиды, кислоты, средние и кислые соли.