- Химия: глубоко системная наука
- Алгоритм решения задачи по химии
- Количество вещества
- Молярная масса
- Молярный объем
- Закон Авогадро
- Относительная плотность газа
- Валентность и степень окисления
- Периодический закон Д. И. Менделеева
- Вычисление скорости химической реакции. химическое равновесие
- Нахождение формулы вещества из результатов анализа
- Строение электронных оболочек атомов
- Расчеты по химическим уравнениям
- Советы по самостоятельному решению задач по химии
Химия: глубоко системная наука
Что в школе (8-9 класс), что в вузе схема решения задач по химии примерно одинакова. Существует определенный набор определенных химических веществ. Каждое из этих веществ обладает определенными характеристиками.
Понимая систему этой науки в целом, а также систему и суть основных веществ, даже будучи гуманитарием до глубины души вы сможете выучить и понять правила решения задач по химии.
А для этого вам понадобятся:
- Необходимая мотивация и готовность работать. Если есть цель и трудолюбие, то все у вас получится, поверьте!
- Хотя бы базовое знание теории: таблица Менделеева, минимальный глоссарий, знание простейших формул соединений и т.д.
- Внимательность. Часто многие проблемы в решении задач химии студенты испытывают из-за банальной невнимательности. Очень тщательно читайте условие задачи, спишите все краткие данные и определите, что же все-таки нужно найти. А дальше все просто – следуем стандартному алгоритму действий.
Алгоритм решения задачи по химии
Для решения задачи по химии следует придерживаться нижеприведенного порядка действий. Чем точнее вы выполните наши рекомендации, тем быстрее будет найдено правильное решение! Итак, давайте перейдем непосредственно к алгоритму решения задач по химии:
- Записать уравнение реакции (при необходимости), не забыть расставить коэффициенты. Для наглядности, над соответствующими соединениями, записать известные и неизвестные данные.
- Определить, каким способом можно найти неизвестные данные. Можно ли это сделать в одно действие или в несколько. Возможно, придется воспользоваться таблицей Менделеева (для определения молекулярной массы, например) или другими справочными данными (например, при переводе массы вещества в объем, необходимо знать его плотность).
- Далее, при необходимости, составить пропорцию (хотя этот способ имеет много противников) или использовать понятие количество вещества. Либо подставить известные и найденные данные в необходимые формулы. Напоминаю, что действий в большинстве случаев больше одного, поэтому определите, какие данные в выбранной формуле для нахождения требуемого параметра, неизвестны и постарайтесь их найти, применяя необходимые пропорции или формулы.
- При необходимости использования формул, следите за единицами измерений. Иногда бывает необходимо перевести их в систему СИ.
- В конце еще раз прочитать условие задачи по химии и проверить правильность ее решения.
И последнее, если не получается решить задачу по химии, то забудьте о том, каким способом вы ее решали. Попробуйте подойти к ней с «другой стороны», найти иной способ решения.
Верьте в свои силы и у вас обязательно все получится. Решать задачи по химии это не так сложно, как кажется! Успехов!
Количество вещества
Несколько столетий тому назад алхимики, готовясь к различным опытам и после их проведения, нередко взвешивали вещества, определяли их объемы. После открытия М. В. Ломоносовым и А. Л. Лавуазье закона сохранения массы веществ при химических реакциях химия начала быстро развиваться, обретая статус точной науки. Расчеты стали неотъемлемой частью химических исследований.
Вы уже знаете, что вещества могут иметь молекулярное, атомное или ионное строение. Превращение одних веществ в другие происходит в результате соединения атомов в молекулы, распада молекул на атомы, перегруппировки атомов или ионов.
Комментируя реакцию горения углерода
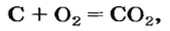
вы скажете, что каждый атом Карбона взаимодействует с молекулой кислорода с образованием молекулы углекислого газа, два атома Карбона взаимодействуют с двумя молекулами кислорода, образуя две молекулы углекислого газа, и т. д.
Чтобы подготовить какой-либо химический опыт, не имеет смысла пересчитывать атомы, молекулы. Да это и невозможно сделать. Химики используют физическую величину, которая определяется количеством частиц вещества в определенной его порции. Название этой величины — количество вещества. Ее обозначают латинской буквой 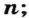
Единицей измерения количества вещества является моль*.
Ученые установили, что 1 моль любого вещества содержит 602 ООО ООО ООО ООО ООО ООО ООО его формульных единиц (атомов, молекул, совокупностей ионов). Это число можно записать как 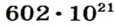
(21 — количество нулей в первой записи), или 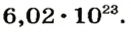 1 моль — это порция вещества, которая содержит
1 моль — это порция вещества, которая содержит 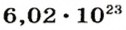 его формульных единиц.
его формульных единиц.
Так, 1 моль углерода (вещество атомного строения) содержит 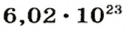
атомов Карбона, 1 моль кислорода (вещество молекулярного строения) — 6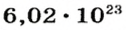
молекул 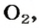 а 1 моль поваренной соли
а 1 моль поваренной соли 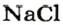 (вещество ионного строения) —
(вещество ионного строения) — 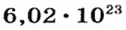 пар ионов
пар ионов 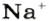 и
и 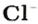 , т. е.
, т. е. 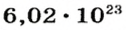 ионов
ионов 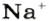 и
и 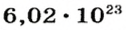 ионов
ионов 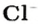 .
.
* Термин происходит от латинского слова moles — бесконечное
Понятие «количество вещества» используют не только по отношению к веществам, но и по отношению к частицам — атомам, молекулам, ионам. Например, выражение «1 моль ионов 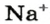 » означает
» означает 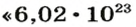 ионов
ионов 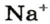 ».
».
Число 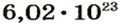 было выбрано не случайно. Ученые определили, что столько атомов содержится в 12г углерода — массе этого простого вещества в граммах, которая численно равна относительной атомной массе соответствующего элемента (Карбона). Отсюда — такое определение единицы измерения количества вещества:
было выбрано не случайно. Ученые определили, что столько атомов содержится в 12г углерода — массе этого простого вещества в граммах, которая численно равна относительной атомной массе соответствующего элемента (Карбона). Отсюда — такое определение единицы измерения количества вещества:
1 моль — это порция вещества, которая содержит столько формульных единиц, сколько атомов Карбона содержится в 12 г углерода.

Представление о порциях различных веществ в 1 моль можно получить из рисунка 1.
Число 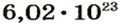 назвали числом Авогадро в честь итальянского ученого А. Авогадро.
назвали числом Авогадро в честь итальянского ученого А. Авогадро.
Число Авогадро в миллиарды раз превышает количество волос на головах, в усах, бородах всех живущих на Земле людей. Если покрыть земную поверхность таким количеством (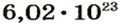 ) теннисных мячей, то толщина «покрытия» будет составлять приблизительно 100 км. Если же разместить
) теннисных мячей, то толщина «покрытия» будет составлять приблизительно 100 км. Если же разместить 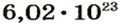 атомов Гидрогена, наименьших среди всех атомов, вплотную друг к другу в линию, то ее длина составит приблизительно
атомов Гидрогена, наименьших среди всех атомов, вплотную друг к другу в линию, то ее длина составит приблизительно 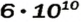
км. Нитью такой длины можно обмотать земной шар по экватору более чем 1 500 ООО раз (рис. 2).
Амедео Авогадро (1776—1856)

Выдающийся итальянский физик и химик. Выдвинул гипотезу о молекулярном строении веществ, в частности газов. Открыл один из законов для газов (1811 год), позже названный его именем. Уточнил атомные массы некоторых элементов, определил состав молекул воды, аммиака, углекислого и угарного газов, метана, сероводорода и др. Разработал экспериментальные методы определения молекулярных масс газообразных веществ.

Числу Авогадро отвечает постоянная Авогадро. Ее обозначение — 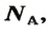
а размерность вытекает из такого выражения:
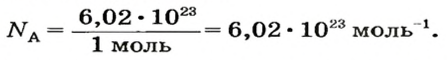
Если порция вещества содержит N частиц (формульных единиц), то можно вывести формулу для вычисления соответствующего количества вещества n:
в 1 моль вещества содержится 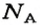
частиц,
в n моль вещества — N частиц;
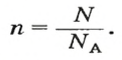
Слово «моль» не склоняется, если перед ним есть число, но склоняется, если числа нет.
Примеры словосочетаний: взято 5 моль железа, определение моля.
Решение задач. Решим несколько задач, в которых используется величина «количество вещества».
ЗАДАЧА 1. В каком количестве вещества содержится 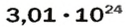
атомов Алюминия?
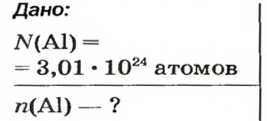
Решение
Воспользуемся формулой, которая отображает связь между количеством вещества и числом частиц (атомов):
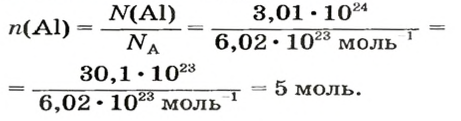
Ответ: 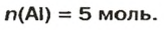
В 1 моль какого-либо молекулярного вещества всегда содержится больше чем 1 моль атомов (1 моль элемента). Например, в 1 моль кислорода 
— 2 моль атомов Оксигена (2 моль элемента Оксигена); в 1 моль метана 
— 1 моль атомов Карбона и 4 моль атомов Гидрогена (1 моль Карбона и 4 моль Гидрогена).
Количества вещества ионов в ионном соединении вычисляют аналогично.
ЗАДАЧА 2. Рассчитать количества вещества ионов в феррум (Ш) оксиде 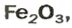
взятом количеством вещества 4 моль.
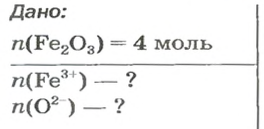
Решение
Формульная единица оксида 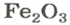
содержит 2 иона 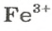
и 3 иона 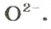
Поэтому 1 моль 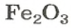
состоит из 2 моль ионов 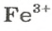
и 3 моль ионов 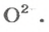
В 4 моль этого соединения количества вещества ионов в четыре раза больше:
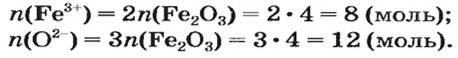
Ответ: 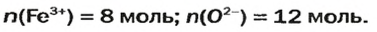
По формуле соединения можно определить соотношение в нем количеств вещества атомов (элементов), ионов. Например, в метане 
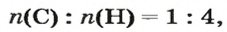
а в феррум(Ш) оксиде 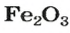
—
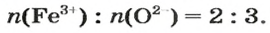
Вернемся к химической реакции 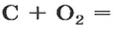
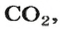
рассмотренной в начале параграфа. Если вести речь о большом количестве частиц, которые взаимодействуют и образуются, то каждые 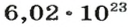
атомов Карбона (1 моль) реагируют с 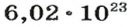
молекул 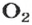
(1 моль) с образованием 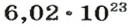
молекул 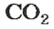
(1 моль). Записав химическое уравнение
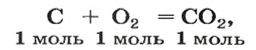
видим, что количества вещества соответствуют коэффициентам. Это справедливо для любой реакции. Приведем еще один пример:
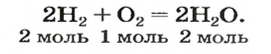
ВЫВОДЫ. Количество вещества в химии определяют числом его частиц. Единица измерения количества вещества — моль. 1 моль содержит 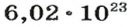
формульных единиц вещества — атомов, молекул, совокупностей ионов. Число 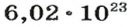
называют числом Авогадро.
Это интересно. Количество вещества используют для характеристики состава растворов в научных исследованиях.
Молярная масса
Важной величиной, которая связана с количеством вещества, является молярная масса. Ее используют во многих вычислениях — при подготовке к химическому эксперименту, внедрении технологических процессов на заводах, для обработки результатов исследования химических реакций.
Молярная масса — это масса 1 моль вещества.
Молярную массу обозначают латинской буквой М. Ее размерность — г/моль.
Молярная масса численно равна относительной атомной, молекулярной или формульной массе.
Для того чтобы записать молярную массу какого-либо вещества, достаточно указать значение соответствующей относительной атомной, молекулярной или формульной массы и добавить размерность — г/моль. Относительные атомные массы элементов представлены в периодической системе Д. И. Менделеева, а относительные молекулярные и формульные массы веществ вы научились вычислять в 7 классе.
Примеры записи молярных масс простых и сложных веществ:
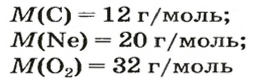
(расчет относительной молекулярной массы:
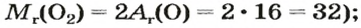
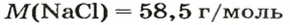
(расчет относительной формульной массы:
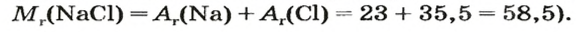
Поскольку понятие «моль» используют не только по отношению к веществам, но и по отношению к частицам (атомам, молекулам, ионам), то и для них существуют молярные массы. Учитывая, что масса 1 моль атомов Гидрогена составляет 1 г, а 1 моль ионов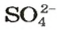
— 96 г, запишем молярные массы этих частиц:
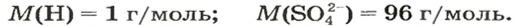
Выведем формулу, которая описывает взаимосвязь между массой, количеством вещества и молярной массой. Если, например, 1 моль атомов Гидрогена имеет массу 1 г, то n моль этих атомов — массу, которая в n раз больше, т. е. n г. Запишем соответствующее математическое выражение:

Общая формула для вычисления массы атомов, ионов, веществ по количеству вещества:
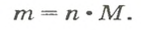
Отсюда
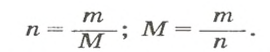
Итак, молярная масса — это отношение массы к количеству вещества.
Решение задач. Рассмотрим два способа решения задач, которые предполагают использование молярной массы. Один из них предусматривает составление пропорции, а другой — вычисления по приведенным выше формулам.
ЗАДАЧА 1. Рассчитать количество вещества метана 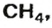
если масса соединения составляет 6,4 г.
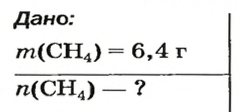
Решение
1-й способ
1. Вычисляем молярную массу соединения: 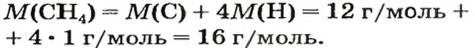
2. Находим количество вещества метана, составив пропорцию:
1 моль 
имеет массу 16 г,
моль 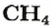
— 6,4 г;
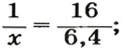
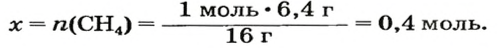
2-й способ
Воспользуемся одной из формул, приведенных в параграфе:
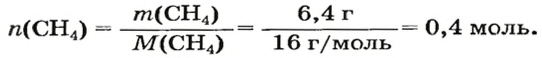
Ответ: 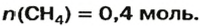
ЗАДАЧА 2. Какая масса железа отвечает количеству вещества 1,5 моль?
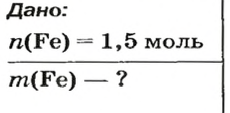
Решение
1-й способ
Железо — простое вещество, состоящее из атомов элемента Феррума.
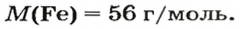
Рассчитываем массу железа с помощью пропорции:
1 моль 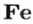
имеет массу 56 г,
1,5 моль 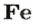
— 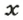
г;
2-й способ
Воспользуемся формулой, приведенной в параграфе:
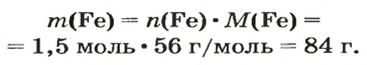
Ответ: 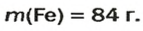
ЗАДАЧА 3. Вычислить массу 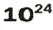
атомов Натрия.
Решение
1-й способ
Поскольку 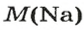
= 23 г/моль, то 1 моль атомов Натрия имеет массу 23 г. Учитывая, что 1 моль элемента — это 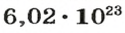
атомов, составляем пропорцию и решаем ее:
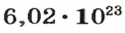
атомов Na имеют массу 23 г,
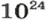
атомов Na — х г;
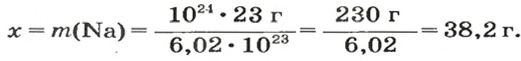
2-й способ
1. Рассчитываем количество вещества Натрия:
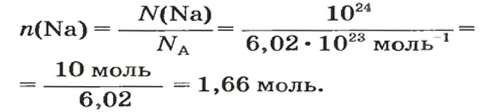
2. Вычисляем массу атомов Натрия:
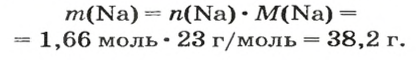
Ответ: 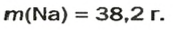
ВЫВОДЫ. Молярная масса — это масса 1 моль вещества. Она численно равна относительной атомной, молекулярной или формульной массе. Молярная масса является отношением массы к количеству вещества.
Молярный объем
Порцию вещества можно охарактеризовать не только ее массой, но и объемом. Поэтому не случайно, что, кроме молярной массы, существует другая физическая величина — молярный, объем.
Молярным объемом называют объем 1 моль вещества.
Обозначение молярного объема — 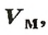
а единицы измерения — 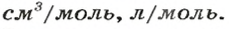
Из курса физики 7 класса вам известна формула, в которую входят масса вещества 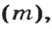
его плотность 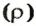
и объем 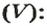
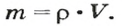
Аналогичная связь существует между молярной массой и молярным объемом:
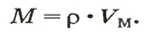
Из этой формулы получаем другую:
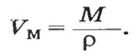
По ней можно вычислять молярный объем любого вещества. Для этого нужно рассчитать молярную массу вещества и найти в справочнике его плотность.
Для каждого твердого и жидкого вещества существует свой молярный объем (например, для алюминия, поваренной соли, воды и спирта — 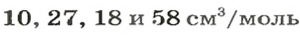
соответственно). Молярный объем, как и плотность таких веществ, почти не зависит от температуры и давления.
Газы при нагревании или понижении давления заметно расширяются, а при охлаждении или повышении давления сжимаются. Это происходит потому, что расстояния между молекулами в газах очень большие (в отличие от твердых и жидких веществ, где частицы соприкасаются друг с другом).
При изменении условий изменяются также плотность газа и его молярный объем. Поэтому, приводя значения этих физических величин, обязательно указывают соответствующие температуру и давление.
Нормальные условия (н. у.) = О °С; 101,3 кПа
Для газов при н. у. 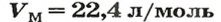
Ученые установили, что молярный объем различных газов при одинаковых условиях один и тот же. В частности, при температуре О °С и давлении 101,3 кПа (или 760 мм рт. ст.) он составляет 22,4 л/моль. Приведенные условия называют нормальными (сокращенно — н. у.).
1 моль любого газа при нормальных условиях занимает объем 22,4 л.
Описывая физические свойства вещества, указывают его агрегатное состояние при обычных условиях. В этом случае речь идет об условиях, которые чаще всего существуют в помещении, где изучают или используют вещество. Это — температура приблизительно +20 °С и давление приблизительно 760 мм рт. ст.
Связь между объемом 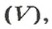
количеством вещества 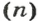
и молярным объемом 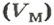
описывает такая формула (попробуйте вывести ее самостоятельно):
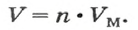
Из нее можно получить две другие:
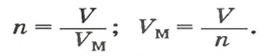
Итак, молярный объем — это отношение объема к количеству вещества.
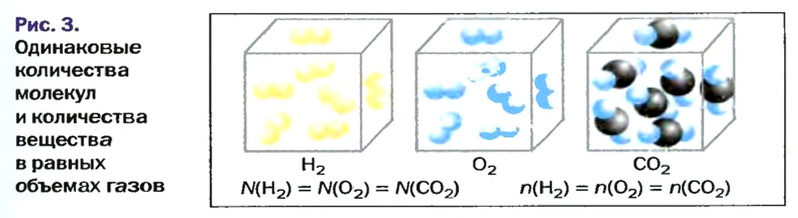
Закон Авогадро
Вы уже знаете, что 1 моль водорода, кислорода или углекислого газа занимает при нормальных условиях объем 22,4 л и содержит 
молекул. Гипотезу об одинаковом количестве молекул в равных объемах различных газов, которая базировалась на результатах исследований реакций между газами, высказал еще в начале
XIX ст. А. Авогадро. Получив впоследствии экспериментальное подтверждение и теоретическое обоснование, эта гипотеза стала законом.
Закон Авогадро формулируют так:
в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул*.
Приводим важное следствие закона Авогадро:
в равных объемах различных газов при одинаковых температуре и давлении содержатся одинаковые количества вещества.
* — Для инертных газов — одинаковое число атомов.
Изложенный материал обобщает рисунок 3.
Решение задач. Рассмотрим несколько задач, при решении которых используют молярный объем газа.
ЗАДАЧА 1. Вычислить объем 0,4 г водорода при нормальных условиях.
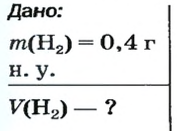
Решение
1-й способ
1. Находим количество вещества водорода:
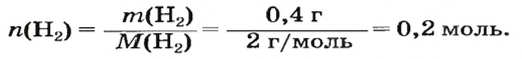
2. Вычисляем объем водорода составлением пропорции:
1 моль 
занимает при н. у. объем 22,4 л, 0,2 моль 
— х л;
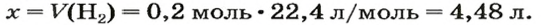
2-й способ
1. Находим количество вещества водорода:
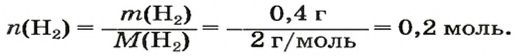
2. Вычисляем объем водорода по соответствующей формуле:
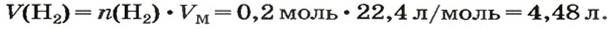
Ответ: 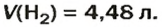
ЗАДАЧА 2. Вычислить количество молекул в 1 л кислорода при нормальных условиях.
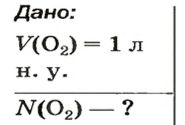
Решение
1-й способ
Вычисляем количество молекул кислорода в 1 л газа при нормальных условиях:
в 22,4 л кислорода содержится 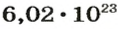
молекул,
в 1 л кислорода — х молекул;
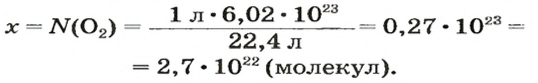
2-й способ
Вычисляем количество молекул кислорода в 1 л газа при нормальных условиях. Для этого из формулы 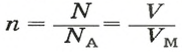
получаем: 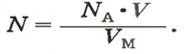
Осуществляем расчет:
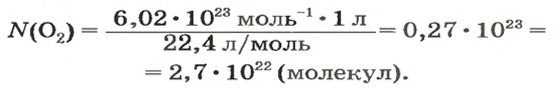
Ответ: 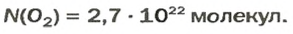
Эту задачу можно решить еще одним способом. По соответствующим формулам сначала вычисляют количество вещества кислорода, а затем — количество молекул.
ЗАДАЧА 3. Рассчитать плотность угарного газа СО при нормальных условиях.
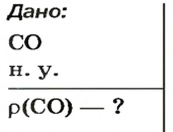
Решение
1-й способ
1. Находим молярную массу угарного газа:
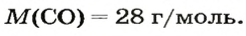
2. Вычисляем плотность газа при нормальных условиях:
1 моль угарного газа, т. е.
28 г СО занимает при н. у. объем 22,4 л,
х г СО — 1л;
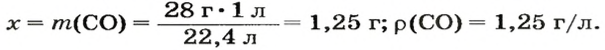
2-й способ
1. Находим молярную массу угарного газа:
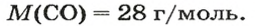
2. Рассчитываем плотность угарного газа при нормальных условиях, преобразовав формулу 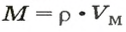
(с. 17) в другую:
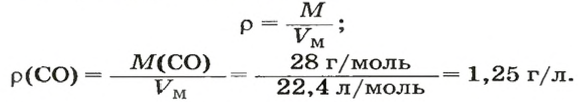
Ответ: 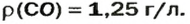
ВЫВОДЫ
Молярный объем — объем 1 моль вещества. Эта физическая величина является отношением объема к количеству вещества.
Молярные объемы твердых и жидких веществ разные, а газов (при одних и тех же температуре и давлении) — одинаковы. При нормальных условиях (температуре О°С и давлении 101,3 кПа, или 760 мм рт. ст.) 1 моль любого газа занимает объем 22,4 л.
В равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул (закон Авогадро).
Соотношение объемов газов в химических реакциях
Согласно закону Авогадро, равные объемы газов содержат одинаковое число молекул (при одинаковых условиях). Если каждая молекула одного газа реагирует с одной молекулой другого, например, во время реакции

то должны взаимодействовать одинаковые объемы веществ, скажем, 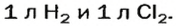
В реакции

на один объем кислорода должны приходиться два объема реагирующего с ним водорода. Только при таком условии число молекул водорода будет вдвое превышать число молекул кислорода, как того «требует» химическое уравнение.
Обобщением этих выводов является закон объемных соотношений газов, который открыл французский ученый Ж. Гей-Люссак в 1808 г.: объемы газов, которые вступают в реакцию и образуются в результате реакции, соотносятся как небольшие целые числа.
Со временем ученые установили, что эти числа являются соответствующими коэффициентами в химических уравнениях.
Итак, для газов в реакциях (1) и (2)
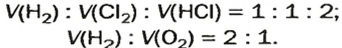
Использование закона Гей Люссака дает возможность химику или инженеру-технологу определить, какие объемы газов нужно взять для осуществления реакции. Отобрать определенный объем газа значительно легче, чем взвесить его необходимую массу.
Относительная плотность газа
В равных объемах различных газов содержится одно и то же число молекул*. Поскольку молекулы различных веществ обычно имеют разную массу, то массы одинаковых объемов газов, как правило, разные. Например, масса 1 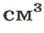
кислорода составляет 0,00143 г, а масса такого же объема водорода — 0,0000893 г. Значит, кислород тяжелее водорода (рис. 4). А во сколько раз? Разделим массу 1 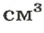
кислорода на массу 1 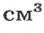
водорода:
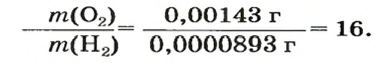
* — При одних и тех же условиях.
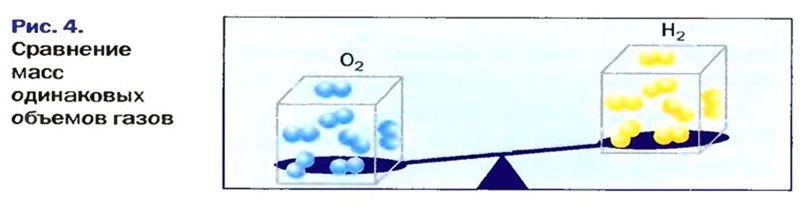
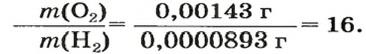
Число 16 называют относительной плотностью кислорода по водороду. Ее обозначают буквой D и записывают так:
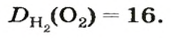
Относительная плотность газа по другому газу — это отношение массы определенного объема газа к массе такого же объема другого газа (при одинаковых температуре и давлении).
Масса 1 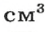
вещества численно равна его плотности. Плотности кислорода и водорода (при нормальных условиях) таковы:
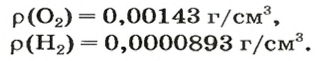
Узнать, во сколько раз кислород тяжелее водорода, можно, разделив плотность кислорода на плотность водорода:
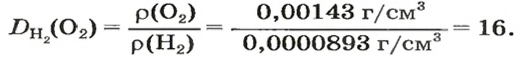
Эта формула объясняет, почему физическую величину, о которой идет речь в параграфе, называют относительной плотностью.
Относительная плотность, как и относительная атомная (молекулярная, формульная) масса, не имеет размерности.
Если взять по 22,4 л кислорода и водорода при нормальных условиях, то массы веществ (в граммах) будут численно равны их молярным массам или относительным молекулярным массам. Отсюда — такие варианты вычисления относительной плотности кислорода по водороду:
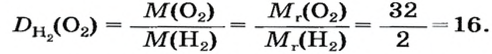
Преобразуем все приведенные выше формулы на общие. Более тяжелый газ обозначим буквой В, более легкий — буквой А, а относительную плотность первого газа по второму — 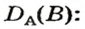
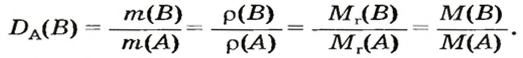
Запомните: соотноы1ение масс газов можно использовать для вычисления относительной плотности лишь при условии, что 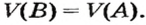
Газы часто сравнивают с воздухом. Хотя воздух является смесью газов, его можно условно считать газом с относительной молекулярной массой 29. Это число называют средней относительной молекулярной массой воздуха. Оно находится в промежутке между числами 32 и 28 — относительными молекулярными массами кислорода 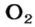
и азота 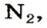
главных компонентов воздуха. (Эти два газа занимают почти 99 % его объема.)
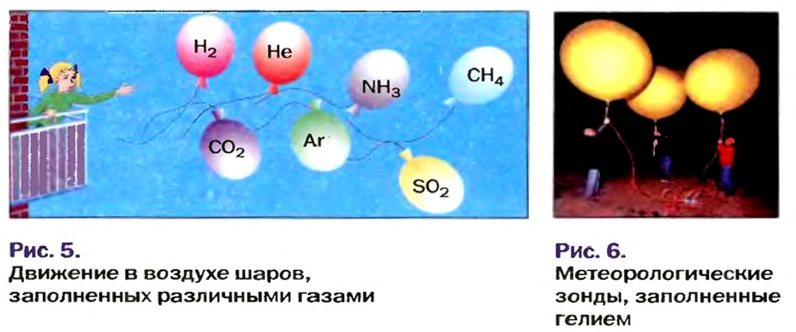
Установить, легче или тяжелее воздуха определенный газ, очень просто. Достаточно заполнить им резиновый шарик и отпустить его (рис. 5, 6).
Формулы для расчета относительной плотности газа В по воздуху имеют такой вид:
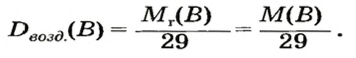
Это интересно. Самый легкий среди газов — водород 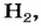
а самый тяжелый — радон 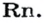
Решение задач. Покажем, как решают задачи с использованием изложенного в параграфе материала.
ЗАДАЧА 1. Рассчитать относительную плотность углекислого газа по водороду и по воздуху.
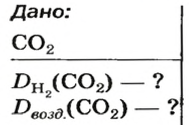
Решение
Находим относительную плотность углекислого газа по водороду и по воздуху.
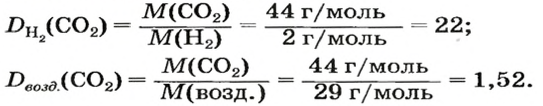
Ответ: 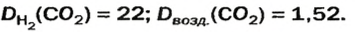
В соответствии с полученным результатом углекислый газ в 1,52 раза тяжелее воздуха. Очевидно, что воздух во столько же раз легче углекислого газа.
Если для неизвестного газа В определена его относительная плотность по газу А, то можно вычислить молярную или относительную молекулярную массы газа В по формулам, которые являются производными от приведенных выше:
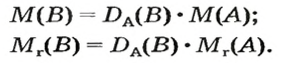
ЗАДАЧА 2. Относительная плотность газа X (соединение Сульфура) по водороду равна 17. Вычислить молярную массу газа Х и найти формулу соединения.
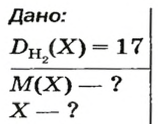
Решение
1. Вычисляем молярную массу газа X по одной из формул, приведенных в параграфе:
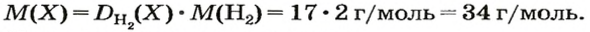
2. Находим формулу соединения. Поскольку 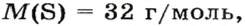
то в молекуле соединения X содержится один атом Сульфура. (Если бы атомов этого элемента было два или больше, то молярная масса соединения превышала бы 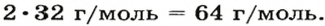
) На второй элемент в молярной массе соединения приходится 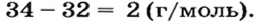
Очевидно, что этим элементом является Гидроген; его атомов в молекуле соединения — два. Формула соединения — 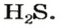
Ответ: 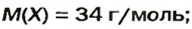
формула соединения — 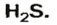
ВЫВОДЫ
Относительная плотность газа по другому газу — это отношение массы определенного объема газа к массе такого же объема другого газа (при одинаковых температуре и давлении). Значение относительной плотности газа показывает, во сколько раз он тяжелее другого газа.
В качестве газа сравнения часто служит воздух. Он ведет себя как газ с относительной молекулярной массой 29.
По относительной плотности газа можно вычислить его молярную массу.
О средней относительной молекулярной массе воздуха.
Почему средняя относительная молекулярная масса воздуха равна 29, а не 30 — среднему арифметическому относительных молекулярных масс кислорода (32) и азота (28)? Потому что в воз духе содержится неодинаковое количество этих газов: кислорода — 21% по объему, азота — 78%.
Вычислим среднюю молярную массу воздуха (она численно равна средней относительной молекулярной массе).
Предположим, что воздух состоит только из кислорода и азота. Тогда средняя молярная масса воздуха будет равна массе 1 моль смеси газов 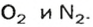
Количества вещества газов пропорциональны их объемам или объемным долям 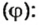
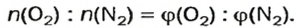
Взяв приближенные значения объемных долей газов 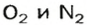
в воздухе (0,2 и 0,8 соответственно), вычислим количество вещества каждого газа в 1 моль смеси:
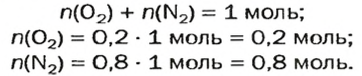
Найдем массу 1 моль воздуха, т. е. 1 моль смеси газов 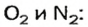
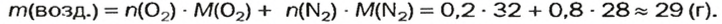
Таким образом, 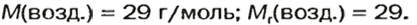
Валентность и степень окисления
Задача: Почему углерод в большинстве своих соединений четырехвалентен?
Решение:
У углерода в невозбужденом атоме электроны на внешнем уровне распределяются по орбиталям так:
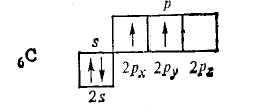
Согласно этой схеме углерод двухвалентен, так как валентность в простейшем случае определяется числом неспаренных электронов. Но у атома углерода имеется одна свободная 2р-орбиталь и при сравнительно небольшой затрате энергии один 2s-электрон переходит в 2р -состояние, в результате чего общее число неспаренных электронов увеличивается до четырех:
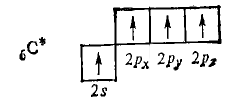
Энергия же, затрачиваемая для 2s—2р-перехода электрона, с избытком компенсируется энергией, которая выделяется при возникновении двух дополнительных связей.
Задача: Определите степень окисления азота в молекулах и ионе: a) 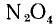
, б) 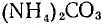
, в) 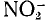
.
Решение:
а) Степень окисления азота х, кислорода —2. Исходя из нейтральности молекулы, составляем уравнение:
2х + 4 (-2) = 0,
откуда х =+4, т. е. степень окисления азота в 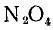
равна +4.
б) Степень окисления водорода равна +1, кислорода —2, углерода в карбонатах (соли угольной кислоты 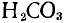
) +4, азота х. Составляем уравнение
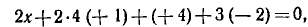
откуда х = —3, т. е. степень окисления азота в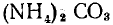
равна —3. 88
в) Степени окисления кислорода и азота равны соответственно —2 и х. Учитывая, что заряд иона 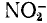
равен —1, составляем уравнение
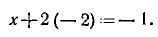
Отсюда х = +3, т. е. степень окисления азота в ионе 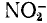
равна +3.
Задача: Определите валентность и степень окисления углерода в соединениях 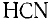
, 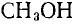
, 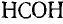
.
Решение:
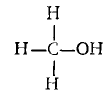
Из структурных формул этих соединений 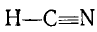
, 
, 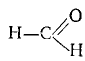
следует, что углерод в этих соединениях четырехвалентен, а степень окисления его будет равна:
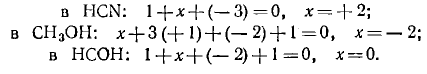
Химическая связь
Задача: Определите, как изменяется прочность соединений в ряду: HF, НСl, НВг, HI.
Решение:
У этих двухатомных молекул прочность связи зависит от длины связи. А поскольку радиус атома при переходе от фтора к иоду возрастает, то длина связи Н—галоген в этом направлении возрастает, т. е. прочность соединений при переходе от фтора к иоду уменьшается.
Задача: Сера образует химические связи с калием, водородом, бромом и углеродом. Какие из связен наиболее и наименее полярны? Укажите, в сторону какого атома происходит смещение электронного облака связи.
Решение:
Используя значения относительных электроотрицательностей атомов (см. табл. 2.2), находим разности относительных элек-троотрицательностей серы и атомов, образующих с нею химическую связь (величину 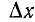
):

Чем больше по абсолютной величине 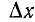
, тем более полярна связь. В данном примере наиболее полярной является связь сера — калий S—К.
Периодический закон Д. И. Менделеева
Задача: В какой группе и каком периоде периодической системы элементов Д. И. Менделеева находится элемент с порядковым номером 42?
Решение:
Расположение элементов в периодической системе в соответствии со строением их атомов следующее: в первом периоде 2, во втором 8, в третьем 8. Третий период заканчивается элементом с порядковым номером 18 (2+8+8=18). В четвертом периоде 18 элементов, т. е. он заканчивается элементом с порядковым номером 36. В пятом периоде также 18 элементов, поэтому элемент с порядковым номером 42 попадает в пятый период. Он занимает шестое место, следовательно, находится в шестой группе. Этот элемент — молибден (Мо).
Задача: Какой из элементов — натрий или цезий — обладает более выраженными металлическими свойствами?
Решение:
Строение электронных оболочек атомов натрия и цезия можно представить следующим образом:
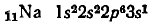
или сокращенно 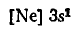
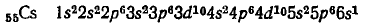
или 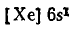
Как видим, у обоих атомов на внешнем энергетическом уровне находится по одному электрону. Однако у атома цезия внешний электрон расположен дальше от ядра (на шестом энергетическом уровне, а у натрия — на третьем) и, следовательно, легче отрывается. Поскольку металлические свойства обусловлены способностью отдавать электроны, они сильнее выражены у цезия.
Задача: Какие соединения с водородом образуют элементы главной подгруппы VI группы? Назовите наиболее и наименее прочное из них.
Решение:
Элементы главной подгруппы VI группы — p-элементы. У них на внешнем электронном уровне по 6 электронов: 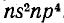
. Следовательно, в соединениях с водородом они проявляют степень окисления — 2. Формулы соединений: 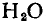
, 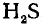
, 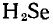
, 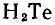
, 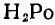
.
С ростом порядкового номера элемента (от кислорода к полонию) увеличивается радиус атома, что обусловливает уменьшение прочности соединения с водородом (от 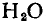
к 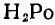
). Таким образом, из названных соединений наиболее прочным является вода 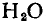
, наименее прочным — 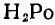
.
Задача: Исходя из места в периодической системе, опишите химические свойства элемента с порядковым номером 23.
Решение:
По периодической системе определяем, что элемент с порядковым номером 23 находится в IV периоде и в побочной подгруппе V группы. Этот элемент — ванадий V. Электронная формула ванадия
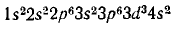
или сокращенно 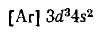
По электронной формуле заключаем, что ванадий — d-элемент.
Элемент может легко отдавать 2 электрона с 4s-подуровня, проявляя степень окисления +2. При этом он образует оксид VO и гидроксид 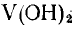
, проявляющие основные свойства. Газообразных водородных соединений ванадий не образует, так как расположен в побочной подгруппе.
Атом ванадия может также отдавать электроны с предвнешнего d-подуровня (3 электрона) и, таким образом, проявляет высшую степень окисления +5 (численно равную номеру группы, в которой расположен элемент). Оксид, соответствующий высшей степени окисления, 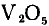
. Этот оксид обладает кислотными свойствами. В качестве гидроксида ему соответствует неустойчивая метаванадиевая кислота 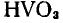
(соли ее — ванадаты — устойчивые соединения).
Вычисление скорости химической реакции. химическое равновесие
Задача: Равновесие реакции 2NO + О2 2NО2 установилось в таких концентраций реагирующих веществ, моль/л C (NO) = 0,5; С (О2) = 0,7; C (NO2) = 2,1. Как изменятся скорости прямой и обратной реакций, если в системе уменьшить общее давление в 2 раза? Нарушится ли при этом равновесие реакции? Ответ подтвердите расчетами.
Решение:
Равновесные концентрации
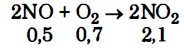
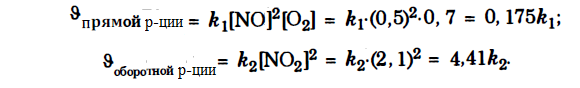
В случае уменьшения давления в 2 раза концентрации всех реагирующих веществ уменьшатся вдвое. Тогда
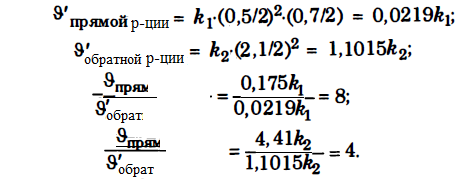
Ответ. Скорость обратной реакции будет в 2 раза больше, чем прямой. Равновесие сместится влево, то есть в сторону разложения NО2.
Задача: Смесь оксида углерода (II) и водяного пара, содержащего 50% СО и 50% Н2О (по объему), пропустили при 1400 К над железным катализатором. Константа равновесия реакции СО + Н2О = СО2 + Н2 равна 0,5. Вычислите выход продуктов и состав равновесной газовой смеси в процентах (по объему).
Решение:

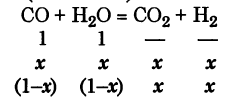
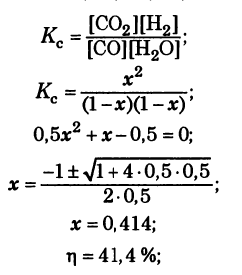
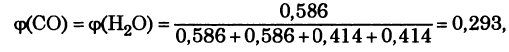
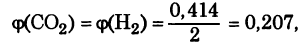
Ответ. 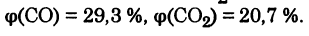
Задача: Для реакции N2 + О2 -> 2NO при 2400 ° С Кс = 0,0035. Рассчитайте состав смеси в состоянии равновесия в процентах по объему, если исходная смесь содержит одинаковые количества N2 и О2.
Решение:

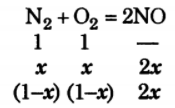
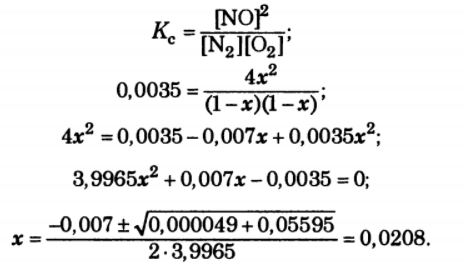
Равновесные концентрации соответственно составляют:
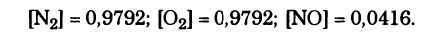
Для газов 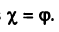
Ответ. 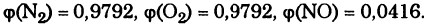
Задача: В сосуде объемом 10 л при 400 ° С смешали 2 г водорода и 80 г брома. В состоянии равновесия 20% брома превратилось в бромоводород. Сколько бромоводорода содержится в равновесной смеси, если исходное количество брома уменьшить в 2 раза?
Решение:
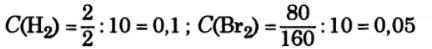

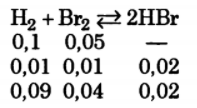
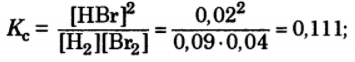

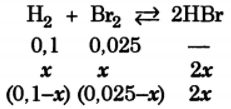

Ответ.
Задача: Химическое равновесие реакции СО2 + Н2 
СО + Н2О установилось при таких концентрациях реагирующих веществ, моль/л 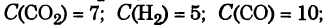
С (Н2О) = 14. Равновесие системы было нарушено из-за уменьшения концентрации Н2О до 11 моль/л. Вычислите новые равновесные концентрации реагирующих веществ после нарушения равновесия.
Решение:
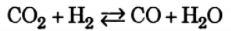
Равновесные концентрации 
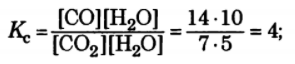
Равновесные концентрации 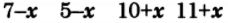
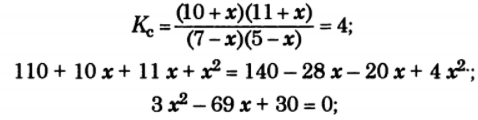
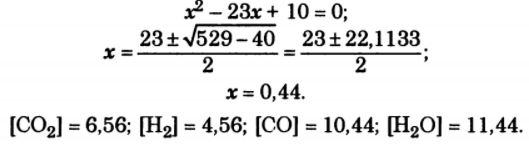
Ответ. 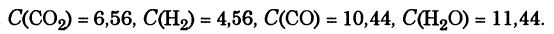
Задача: Химическое равновесие реакции 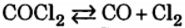
установилось в таких концентрациях реагирующих веществ, моль/л: С(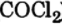
) = 10; С (СО) = 2; С (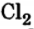
) = 4. В равновесную систему добавили хлор в количестве 4 моль/л. Определите новые равновесные концентрации реагирующих веществ после нарушения равновесия.

Ответ: 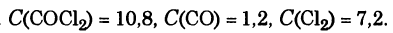
Задача: Состав реакционной смеси (%) в момент равновесия для реакции 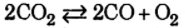
по объему был следующим: 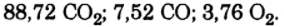
Найдите 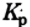
и 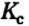
для этой реакции, если общее давление в системе при данной температуре (2273 К) равна 1,0133•105 Па.
Решение:
I способ
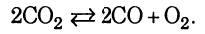
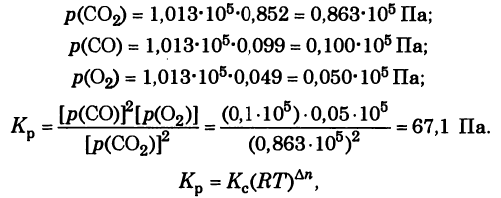
где 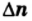
= 3-2 = 1; 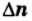
— разница между числами молей газообразных продуктов реакции и газообразных исходных веществ;
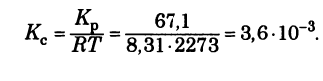
II способ

Ответ. 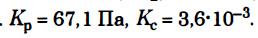
Нахождение формулы вещества из результатов анализа
Задача: Определите формулу вещества, содержащего 40% кальция, 12% углерода и 48% кислорода.
Решение:
Обозначим число молей атомарного кальция в 1 моль вещества через х, углерода — через у, кислорода — через z. Формула вещества будет 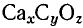
. 100 г этого вещества содержит 40 г Са, 12 г С и 48 г О. Молярные массы атомов равны: кальция 40 г/моль, углерода 12 г/моль, кислорода 16 г/моль. Если разделить массы всех элементов на молярные массы их атомов, то мы получим соотношение числа молей атомов в соединении:
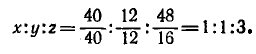
Формула соединения СаСОз.
Задача: Вещество содержит 20% водорода и 80% углерода. Определите формулу этого вещества, если его молярная масса равна 30 г/моль.
Решение:
Представим формулу вещества в виде 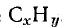
, где х и у — число молей атомарных С и Н в I моль вещества. Молярные массы равны: углерода 12 г/моль, водорода 1 г/моль. В 100 г 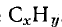
содержится 80 г С и 20 г Н. Находим отношение х и у:
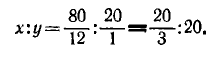
Приняв 20/3 за единицу, получаем х : у= 1 : 3, откуда
у= Зх. (а)
Зная, что молярная масса соединения равна 30 г/моль, можно записать
12x + y = 30. (б)
Из системы уравнений (а) и (б) получаем х = 2, у = 6. Следовательно, формула соединения 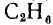
.
Задача: При полном сжигании соединения серы с водородом получено 3,6 г воды и 12,8 г оксида серы (IV). Определите формулу исходного соединения.
Решение:
Представим формулу соединения в виде 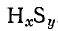
, где х — число молей атомов Н, у — число молей атомов серы, содержащихся в 1 моль вещества. Для решения задачи определяем молярные массы: воды 18 г/моль, оксида серы (IV) 64 г/моль, атомов Н 1 г/моль, атомов серы 32 г/’моль. На основании формул продуктов горения и молярных масс получаем, что 1
18 г= 18 г 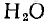
может быть получено из 2• 1 г =2 г Н:
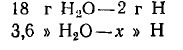
Составляем пропорцию: 18 : 2=3,6 : х, откуда
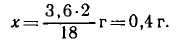
Аналогично, 1
64 г = 64 г 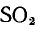
может быть получено из 1
32 г = 32 г S:
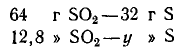
Составляем пропорцию: 64 : 32 = 12,8 : у, откуда
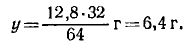
Таким образом, исходное соединение содержало 0,4 г водорода и 6,4 г серы. Разделив массы водорода и серы на молярные массы их атомов, получим отношение числа молей атомов Н и S:
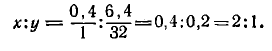
Формула исходного соединения 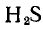
Строение электронных оболочек атомов
Задача: Напишите электронную формулу элемента, атом которого содержит на Зd-подуровне один электрон. В каком периоде, группе и подгруппе он находится и как этот элемент называется?
Решение:
В соответствии со шкалой энергии (см. § 2.7 и рис. 2.3), ЗЛ-подуровень заполняется после заполнения подуровня 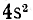 :
:
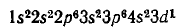
или
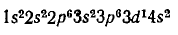 .
.
Общее число электронов в атоме, которое определяет порядковый номер элемента в периодической системе,— 21. Это — скандий. Из электронной формулы видно, что этот элемент находится в IV периоде, третьей группе (три валентных электрона 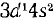
), побочной подгруппе (элемент d-семейства).
Задача: Составьте электронную формулу и сокращенную электронную формулу элемента с порядковым номером 20. Покажите распределение электронов по квантовым ячейкам (орбиталям).
Решение:
По порядковому номеру заключаем: в атоме 20 электронов. Данный элемент — кальций. Электронная формула в соответствии с принципом наименьшей энергии (см. § 2.7) имеет вид
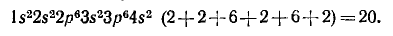
Более компактное написание электронной формулы — ее называют сокращенной электронной формулой — будет
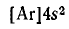
В ней та часть ее, которая соответствует заполненным электронным уровням благородного газа, обозначается его символом (в квадратных скобках) и рядом изображаются остальные электроны.
Электронной формуле атома кальция соответствует следующее распределение электронов по орбиталям:
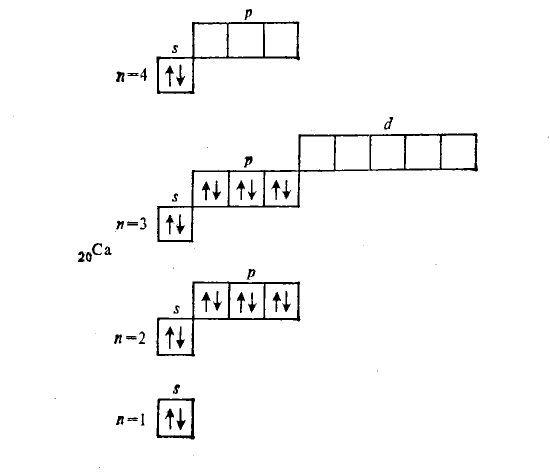
Расчеты по химическим уравнениям
Расчеты по химическим уравнениям (стехиометрические расчеты) основаны на законе сохранения массы веществ. Однако в реальных химических процессах из-за неполного протекания реакции и различных потерь веществ масса образующихся продуктов часто бывает меньше той, которая должна образоваться в соответствии с законом сохранения массы веществ. Выход продукта реакции (или массовая доля выхода) – это выраженное в процентах отношение массы реально полученного продукта к его массе, которая должна образоваться в соответствии с теоретическим расчетом, т.е.
η = [mp(X) •100]/m(X)
Где η– выход продукта, %; mp(X) — масса продукта Х, полученного в реальном процессе; m(X) – рассчитанная масса вещества Х.
В тех задачах, где выход продукта не указан, предполагается, что он – количественный (теоретический), т.е. η=100%.
9. Какую массу фосфора надо сжечь для получения оксида фосфора (V) массой 7,1 г?
Дано: m(P2O5)=7,1 г.
Найти: m(Р) =?
Решение: записываем уравнение реакции горения фосфора и расставляем стехиометрические коэффициенты.
4P+ 5O2 = 2P2O5
Определяем количество вещества P2O5, получившегося в реакции.
ν(P2O5) = m(P2O5)/ М(P2O5) = 7,1/142 = 0,05 моль.
Из уравнения реакции следует, что ν(P2O5)= 2•ν(P), следовательно, количество вещества фосфора, необходимого в реакции равно:
ν(P2O5)= 2•ν(P) = 2• 0,05= 0,1 моль.
Отсюда находим массу фосфора:
m(Р) = ν(Р) • М(Р) = 0,1• 31 = 3,1 г.
10. В избытке соляной кислоты растворили магний массой 6 г и цинк массой 6,5 г. Какой объем водорода, измеренный при нормальных условиях, выделится при этом?
Дано: m(Mg)=6 г; m(Zn)=6,5 г; н.у.
Найти: V(H2) =?
Решение: записываем уравнения реакции взаимодействия магния и цинка с соляной кислотой и расставляем стехиометрические коэффициенты.
Zn + 2 HCl = ZnCl2 + H2↑
Mg + 2 HCl = MgCl2 + H2↑
Определяем количества веществ магния и цинка, вступивших в реакцию с соляной кислотой.
ν(Mg) = m(Mg)/ М(Mg ) = 6/24 = 0,25 моль
ν(Zn) = m(Zn)/ М(Zn) = 6,5/65 = 0,1 моль.
Из уравнений реакции следует, что количество вещества металла и водорода равны, т.е. ν(Mg) = ν(Н2); ν(Zn) = ν(Н2), определяем количество водорода, получившегося в результате двух реакций:
ν(Н2) = ν(Mg) + ν(Zn) = 0,25 + 0,1= 0,35 моль.
Рассчитываем объем водорода, выделившегося в результате реакции:
V(H2) = Vm • ν(H2) = 22,4 • 0,35 = 7,84 л.
11. При пропускании сероводорода объемом 2,8 л (нормальные условия) через избыток раствора сульфата меди (II) образовался осадок массой 11,4 г. Определите выход продукта реакции.
Дано: V(H2S)=2,8 л; m(осадка)= 11,4 г; н.у.
Найти: η =?
Решение: записываем уравнение реакции взаимодействия сероводорода и сульфата меди (II).
H2S + CuSO4 = CuS ↓+ H2SO4
Определяем количество вещества сероводорода, участвующего в реакции.
ν(H2S) = V(H2S) / Vm = 2,8/22,4 = 0,125 моль.
Из уравнения реакции следует, что ν(H2S) = ν(СuS) = 0,125 моль. Значит можно найти теоретическую массу СuS.
m(СuS) = ν(СuS) • М(СuS) = 0,125 • 96 = 12 г.
Теперь определяем выход продукта, пользуясь формулой (4):
η = [mp(X) •100]/m(X)= 11,4 • 100/ 12 = 95%.
12. Какая масса хлорида аммония образуется при взаимодействии хлороводорода массой 7,3 г с аммиаком массой 5,1 г? Какой газ останется в избытке? Определите массу избытка.
Дано: m(HCl)=7,3 г; m(NH3)=5,1 г.
Найти: m(NH4Cl) =? m(избытка) =?
Решение: записываем уравнение реакции.
HCl + NH3 = NH4Cl
Эта задача на «избыток» и «недостаток». Рассчитываем количества вещества хлороводорода и аммиака и определяем, какой газ находится в избытке.
ν(HCl) = m(HCl)/ М(HCl) = 7,3/36,5 = 0,2 моль;
ν(NH3) = m(NH3)/ М(NH3) = 5,1/ 17 = 0,3 моль.
Аммиак находится в избытке, поэтому расчет ведем по недостатку, т.е. по хлороводороду. Из уравнения реакции следует, что ν(HCl) = ν(NH4Cl) = 0,2 моль. Определяем массу хлорида аммония.
m(NH4Cl) = ν(NH4Cl) • М(NH4Cl) = 0,2• 53,5 = 10,7 г.
Мы определили, что аммиак находится в избытке (по количеству вещества избыток составляет 0,1 моль). Рассчитаем массу избытка аммиака.
m(NH3) = ν(NH3) • М(NH3) = 0,1• 17 = 1,7 г.
13. Технический карбид кальция массой 20 г обработали избытком воды, получив ацетилен, при пропускании которого через избыток бромной воды образовался 1,1,2,2 –тетрабромэтан массой 86,5 г. Определите массовую долю СаС2 в техническом карбиде.
Дано: m = 20 г; m(C2H2Br4)=86,5 г.
Найти: ω(СаC2) =?
Решение: записываем уравнения взаимодействия карбида кальция с водой и ацетилена с бромной водой и расставляем стехиометрические коэффициенты.
CaC2 +2 H2O = Ca(OH)2 + C2H2
C2H2 +2 Br2 = C2H2Br4
Находим количество вещества тетрабромэтана.
ν(C2H2Br4) = m(C2H2Br4)/ М(C2H2Br4) = 86,5/ 346 = 0,25 моль.
Из уравнений реакций следует, что ν(C2H2Br4) =ν(C2H2) = ν(СаC2) =0,25 моль. Отсюда мы можем найти массу чистого карбида кальция (без примесей).
m(СаC2) = ν(СаC2) • М(СаC2) = 0,25• 64 = 16 г.
Определяем массовую долю СаC2 в техническом карбиде.
ω(СаC2) =m(СаC2)/m = 16/20 = 0,8 = 80%.
Растворы. Массовая доля компонента раствора
14. В бензоле объемом 170 мл растворили серу массой 1,8 г. Плотность бензола равна 0,88 г/мл. Определите массовую долю серы в растворе.
Дано: V(C6H6) =170 мл; m(S) = 1,8 г; ρ(С6C6)=0,88 г/мл.
Найти: ω(S) =?
Решение: для нахождения массовой доли серы в растворе необходимо рассчитать массу раствора. Определяем массу бензола.
m(С6C6) = ρ(С6C6) •V(C6H6) = 0,88•170 = 149,6 г.
Находим общую массу раствора.
m(р-ра) = m(С6C6) + m(S) =149,6 + 1,8 = 151,4 г.
Рассчитаем массовую долю серы.
ω(S) =m(S)/m=1,8 /151,4 = 0,0119 = 1,19 %.
15. В воде массой 40 г растворили железный купорос FeSO4•7H2O массой 3,5 г. Определите массовую долю сульфата железа (II) в полученном растворе.
Дано: m(H2O)=40 г; m(FeSO4•7H2O)=3,5 г.
Найти: ω(FeSO4) =?
Решение: найдем массу FeSO4 содержащегося в FeSO4•7H2O. Для этого рассчитаем количество вещества FeSO4•7H2O.
ν(FeSO4•7H2O)=m(FeSO4•7H2O)/М(FeSO4•7H2O)=3,5/278=0,0125моль
Из формулы железного купороса следует, что ν(FeSO4)= ν(FeSO4•7H2O)=0,0125 моль. Рассчитаем массу FeSO4:
m(FeSO4) = ν(FeSO4) • М(FeSO4) = 0,0125•152 = 1,91 г.
Учитывая, что масса раствора складывается из массы железного купороса (3,5 г) и массы воды (40 г), рассчитаем массовую долю сульфата железа в растворе.
ω(FeSO4) =m(FeSO4)/m=1,91 /43,5 = 0,044 =4,4 %.
Задачи для самостоятельного решения
- На 50 г йодистого метила в гексане подействовали металлическим натрием, при этом выделилось 1,12 л газа, измеренного при нормальных условиях. Определите массовую долю йодистого метила в растворе. Ответ: 28,4%.
- Некоторый спирт подвергли окислению, при этом образовалась одноосновная карбоновая кислота. При сжигании 13,2 г этой кислоты получили углекислый газ, для полной нейтрализации которого потребовалось 192 мл раствора КОН с массовой долей 28%. Плотность раствора КОН равна 1,25 г/мл. Определите формулу спирта. Ответ: бутанол.
- Газ, полученный при взаимодействии 9,52 г меди с 50 мл 81 % раствора азотной кислоты, плотностью 1,45 г/мл, пропустили через 150 мл 20 % раствора NaOH плотностью 1,22 г/мл. Определите массовые доли растворенных веществ. Ответ: 12,5% NaOH; 6,48% NaNO3; 5,26% NaNO2.
- Определите объем выделившихся газов при взрыве 10 г нитроглицерина. Ответ: 7,15 л.
- Образец органического вещества массой 4,3 г сожгли в кислороде. Продуктами реакции являются оксид углерода (IV) объемом 6,72 л (нормальные условия) и вода массой 6,3 г. Плотность паров исходного вещества по водороду равна 43. Определите формулу вещества. Ответ: С6Н14.
Советы по самостоятельному решению задач по химии
Вот несколько советов, которые, я очень надеюсь, помогут вам в освоении этого нелегкого дела.
- Первое и самое главное – ваше желание, ваш труд и усердие. Поставьте перед собой цель и не отступайте!
- Второе – это теоретические знания, без которых вы просто не сможете правильно написать даже самую простую формулу соединения, не говоря уже об уравнениях реакций между ними. Здесь важно научиться «читать» таблицу Менделеева – самую большую открытую шпаргалку, в которой можно найти сведения о свойствах элементов и образуемых ими соединений.
- Сама задача. Внимательно прочитайте условие задачи по химии и запишите кратко все известные данные, а также что надо найти (иногда даже это вызывает определенные трудности). Далее четко следуем выбранному алгоритму решения химических задач.