- История открытия
- Общее описание
- Номенклатура
- Классификация спиртов
- По количеству гидроксогрупп
- По типу атома углерода, с которым связана гидроксогруппа
- По строению углеводородного радикала
- Изомерия спиртов
- Структурная
- Межклассовая
- Пространственная (оптическая)
- Свойства одноатомных спиртов
- Физические свойства
- Химические свойства
- Получение и применение спиртов (на примере этилового спирта)
- Многоатомные спирты
- Реакции элиминирования (отщепления)
- Дегидратация
- Дегидрирование спиртов
- Реакции окисления
- Горение
- Неполное окисление
- Предельные многоатомные спирты
- Замещение атомов водорода гидроксильных групп
- Замещение гидроксильных групп
- Состав вторичного спирта
- Точки кипения
- Обезвоживание
- Этерификация
- Реактивность
История открытия
История спирта уходят корнями в глубокую древность, ведь согласно археологическим находкам уже 5000 лет тому назад люди умели делать алкогольные напитки: вино и пиво. Делать то умели, но не до конца понимали, какой же такой волшебный элемент имеется в этих напитках, который делает их хмельными. Тем не менее, пытливые умы ученых прошлого не раз пытались выделить из вина этот волшебный компонент, отвечающий за его алкогольность (или крепость, как мы говорим сейчас).
И вскоре обнаружилось, что спирт можно выделить при помощи процесса дистилляции жидкости. Дистилляция спирта это такой химический процесс в ходе, которого летучие компоненты (пары) испаряются, а из перебродившей смеси и получается спирт. К слову сам процесс дистилляции впервые был описан великим ученым и натурфилософом Аристотелем. На практике же получить спирт при помощи дистилляции удалось алхимикам Жа-биру и Зосим де Панополису, именно они, как мы уже писали вначале, и дали спирту его название – «spiritus vini» (дух вина), который со временем стал просто спиртом.
Алхимики более поздних времен усовершенствовали процесс дистилляции и получения спирта, например французский врач и алхимик Арно де Вильгерр в 1334 году разработал удобную технологию получения винного спирта. А уже с 1360 года его наработки переняли итальянские и французские монастыри, которые начали активно производить спирт, называемый ими «Aqua vita» – «живая вода».

В 1386 году «живая вода» впервые попала в Россию (точнее Московию, как тогда называли это государство). Привезенный генуэзским посольством в качестве презента царскому двору спирт очень понравился тамошним боярам (впрочем, и не только боярам). А «живая вода» впоследствии стала основой всем известного алкогольного напитка (употреблять который мы вам, однако, решительно не рекомендуем).
Но вернемся к химии.
Общее описание
В состав одноатомных спиртов входит несколько групп -СН- и одна гидроксильная группа -ОН. Одноатомные спирты происходят от предельных углеводородов – алканов. При замещении одного атома водорода группой -ОН образуется предельный или насыщенный одноатомный спирт. Поэтому общая формула одноатомных спиртов – CnH2n+1-OH или CnH2n+2O.
Названия насыщенных спиртов соответствуют гомологическому ряду алканов с суффиксом «-ол».
Например, этанол, пропанол, бутанол. Наиболее простой одноатомный спирт – метанол – содержит всего один атом углерода (CH3OH). Это первый представитель гомологического ряда одноатомных спиртов.
Химические и физические свойства спиртов обусловлены наличием гидроксила – функциональной группы.
Номенклатура
Номенклатура одноатомных спиртов, как и многоатомных, зависит от названия окружающих радикалов и строения их молекул. Например:
- Тривиальная.
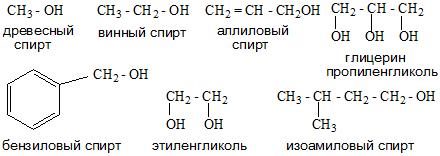
- Систематическая. Она основана на характеристике радикала и выборе углеродной цепи.

- Карбинольная. В основе ее фигурирует название карбинол. На данный момент является устаревшей.
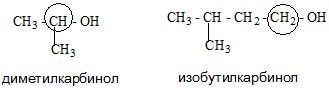
Классификация спиртов
Спирты классифицируют по различным признакам: по количеству гидроксильных групп; по типу атома углерода, с которым связана гидроксогруппа; а также по строению углеводородного радикала.
По количеству гидроксогрупп
По этому признаку выделяют одноатомные и многоатомные спирты.
У одноатомных спиртов одна группа ОН−. Пример — этиловый спирт (этанол):
CH3—CH2—OH(C2H5OH).
У многоатомных — несколько групп ОН−.
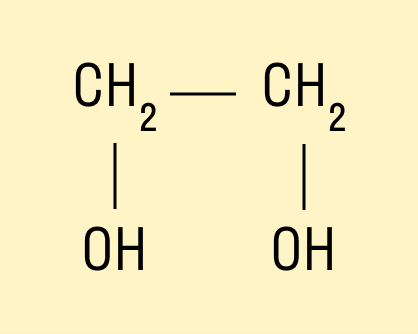
Например, предельный двухатомный спирт этиленгликоль (этандиол):
HO—CH—CH—OH.
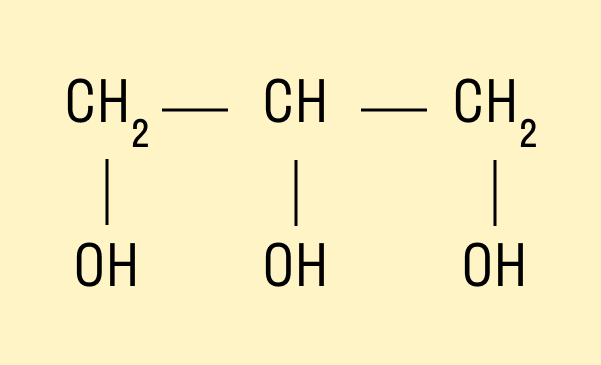
Трехатомный спирт глицерин:
HO—CH2—CH(OH)—CH2—OH.
Современное название многоатомных спиртов — полиолы (диолы, триолы и т. д.).
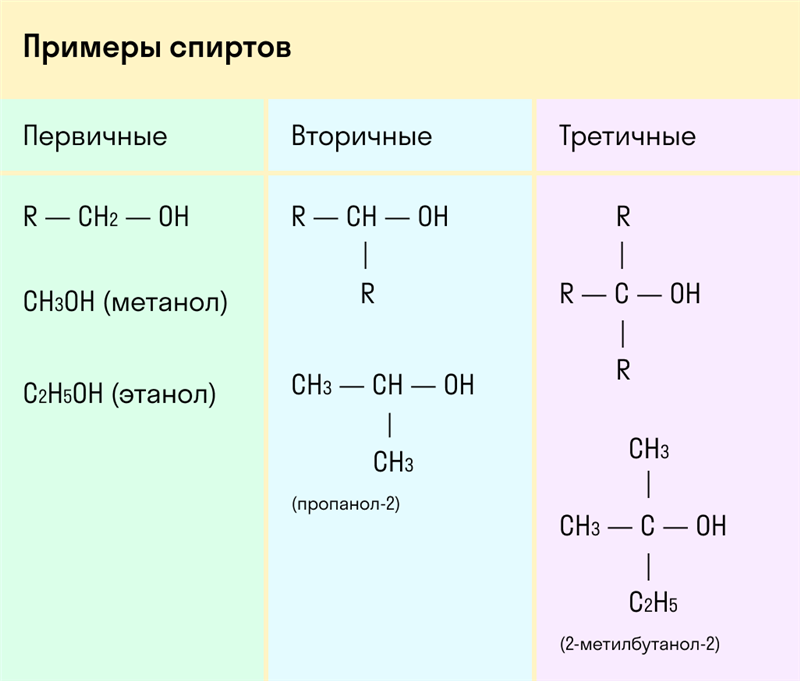
По типу атома углерода, с которым связана гидроксогруппа
Выделяют первичные, вторичные и третичные спирты. Показали примеры каждого вида спиртов в таблице.
По строению углеводородного радикала
По строению углеводородного радикала спирты бывают:
- Предельные (этанол СН3—СН2—ОН);
- Непредельные (пропенол СН2=СН—СН2—ОН);
- Ароматические (фенилметанол С6Н5—СН2ОН).
Изомерия спиртов
Изомерия — это явление существования соединений, у которых одинаковый качественный и количественный состав, но различное строение, а значит, разные свойства.
Давайте рассмотрим виды изомерии, которые характерны для спиртов.
Структурная
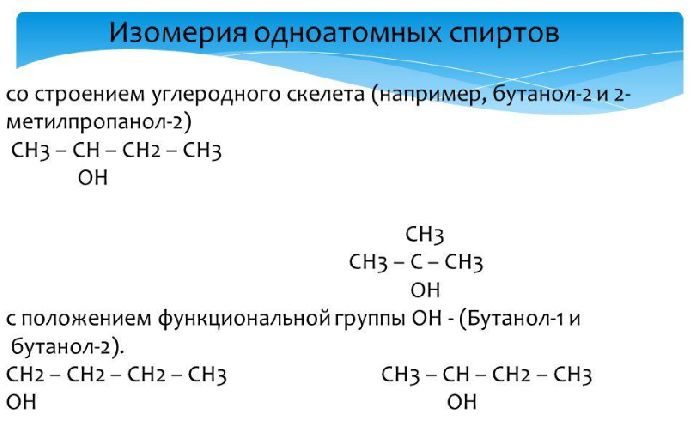
- Изомерия углеродного скелета характерна для спиртов, в состав которых входит четыре и более атомов углерода.
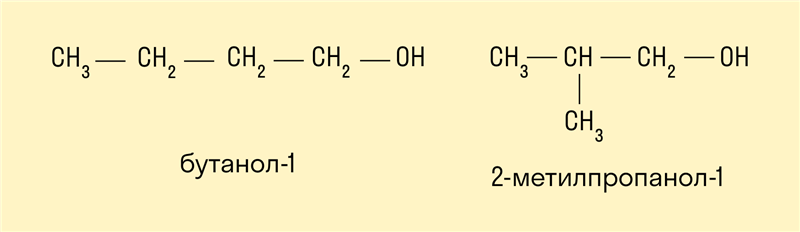
- Изомерия положения гидроксильной группы.
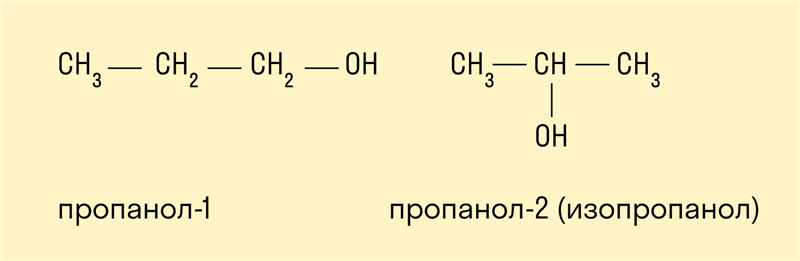
Межклассовая
Межклассовые изомеры — это вещества, которые относятся к разным классам и имеют различное строение, но одинаковый состав.
Для спиртов межклассовыми изомерами являются простые эфиры. Общая формула спиртов и простых эфиров — CnH2n+2O.
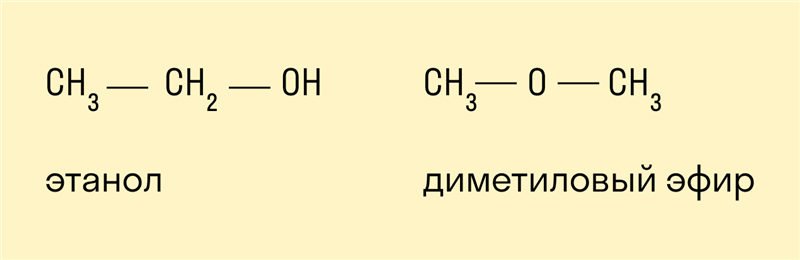
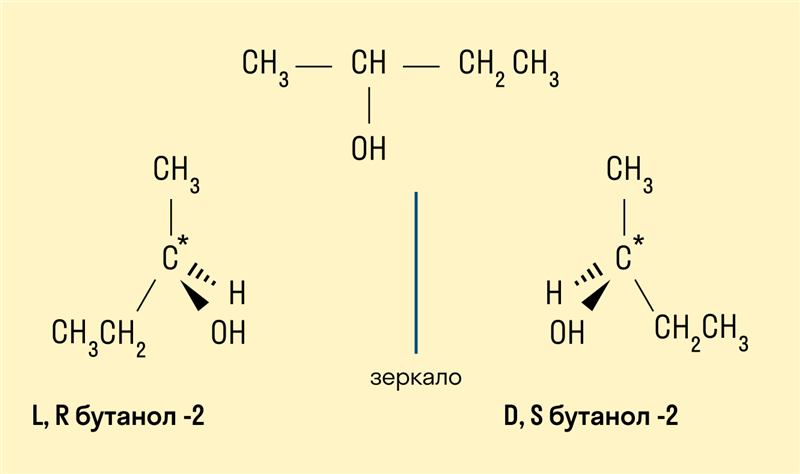
Пространственная (оптическая)
Например, бутанол-2, в молекуле которого второй атом углерода соединен с четырьмя различными заместителями, существует в форме двух различных оптических изомеров.
Свойства одноатомных спиртов
Физические свойства
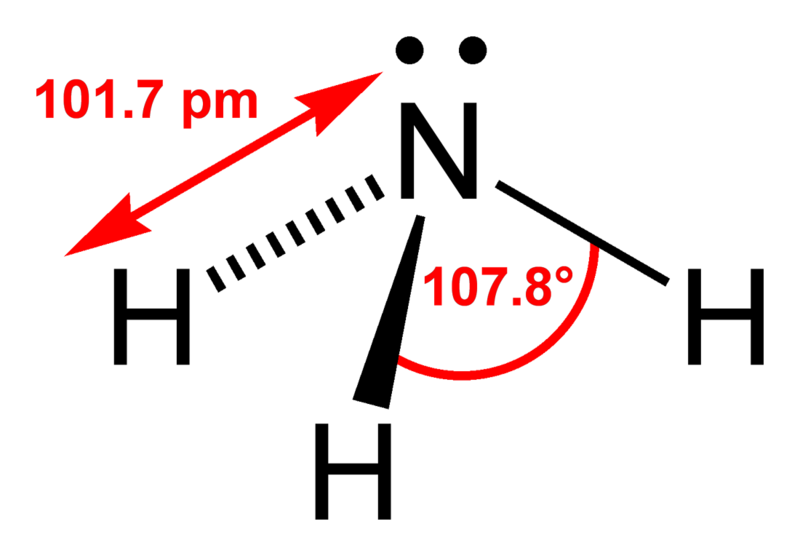
Поскольку в молекуле спирта появились полярные связи, он, в отличие от углеводородов, будет иметь более высокие температуры кипения и плавления (если сравнивать соединения с одинаковым числом атомов углерода). Это связано с тем, что полярные молекулы сильнее притягиваются друг к другу, и для того чтобы оторвать их друг от друга (перевести жидкость в газ), нужно затратить много энергии — дополнительно нагреть. Кроме того, между молекулами спиртов возникают водородные связи (а), которые дополнительно притягивают молекулы друг к другу. Поэтому этиловый спирт — бесцветная жидкость (а этан и диметиловый эфир — газы!) с т. кип. 78 °C. Спирт хорошо растворим в воде, так как и с молекулами воды спирт образует водородные связи (б).
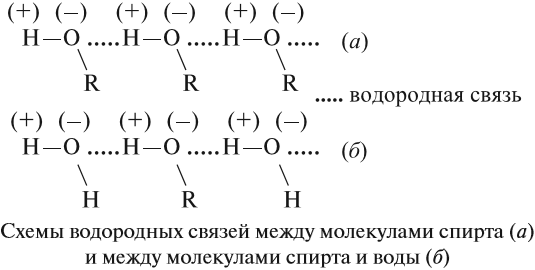
Водородные связи непрочные, поэтому низшие одноатомные спирты (мало атомов углерода в молекуле) — летучие жидкости с характерным запахом.
Химические свойства
Спирты могут реагировать с натрием и другими щелочными металлами. При этом атом водорода ОН-группы замещается на атом металла:
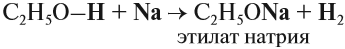
Вопрос. Неорганические вещества какого класса способны вступать в реакции замещения с металлами, в результате чего выделяется водород?
Аналогичную реакцию дают кислоты, поэтому в этой реакции спирт проявляет кислотные свойства. Но это очень слабые свойства, так как растворы спиртов не изменяют окраску индикаторов и не реагируют с растворами щелочей.
Спирты реагируют с неорганическими кислотами:
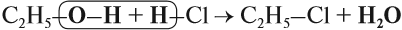
В этой реакции отщепляется молекула воды, — значит, это реакция дегидратации. При записи таких реакций формулы исходных веществ записывайте так, чтобы функциональные группы были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга. Так, в результате реакции дегидратации, в которой участвуют две молекулы спирта, образуется простой эфир (дегидратация межмолекулярная):
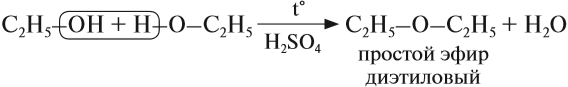
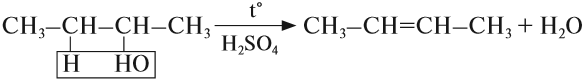
Эта реакция происходит в присутствии концентрированной серной кислоты. Если смесь спирта и концентрированной серной кислоты нагреть сильнее, то молекула воды отщепляется от одной молекулы спирта (дегидратация внутримолекулярная):
Спирты, у которых ОН-группа соединена с первым (последним) атомом углерода углеродной цепочки (первичные спирты) легко окисляются нагретым оксидом меди CuO, превращаясь в альдегиды:
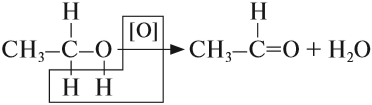
При составлении этой реакции рекомендуется выделить (подчеркнуть) те атомы, которые образуют воду, и записать новую формулу без этих атомов. Спирты горят, образуя, как и углеводороды, углекислый газ и воду.
Задание 22.3. Составьте уравнение реакции горения этилового спирта.
Таким образом, для спиртов характерны реакции:
- замещения атома водорода ОН-группы;
- дегидратации (отщепления воды);
- окисления.
Все эти реакции идут с участием ОН-группы функциональной группы спиртов.
Получение и применение спиртов (на примере этилового спирта)
Этанол и другие спирты можно получить из алкенов.
Вопрос. При помощи какой реакции можно это осуществить (при затруднении см. урок 19.3)?
Задание 22.5. Составьте уравнение этой реакции.
Полученный таким способом спирт используют в технических целях: в качестве растворителя, для получения каучука, пластмасс и др. Кроме того, спирт используют как горючее.
Пищевой и медицинский спирты получают брожением глюкозы:
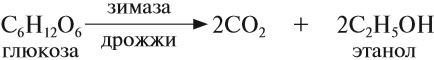
В лаборатории этиловый спирт можно получить гидролизом (взаимодействием с водой) хлорэтана:
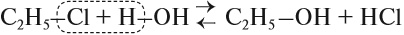
Для того чтобы эта реакция стала необратимой, используют водный раствор щёлочи.
Многоатомные спирты
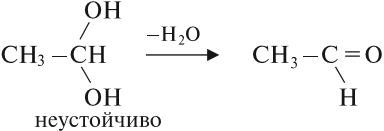
Многоатомные спирты содержат две и более гидроксогруппы в молекуле. При этом каждый атом углерода в молекулах спиртов может соединяться только с одной гидроксогруппой ОН, в противном случае образуются неустойчивые соединения:
Задание 22.7. Составьте формулы многоатомных спиртов, в молекуле которых:
- два атома углерода и две гидроксогруппы;
- три атома углерода и три гидроксогруппы.
У вас получились формулы простейших многоатомных спиртов:

Вопрос. Как в названии спирта обозначить число гидроксогрупп?
Названия по IUPAC этих спиртов составляют, используя уже известные правила, т. е. к названию углеводорода добавляют суффикс ОЛ, а перед ним указывают число ОН-групп при помощи префиксов ди- или три-. Например, этиленгликоль получит название: этандиол.
Задание 22.8. Назовите по правилам IUPAC глицерин.
Вопрос. Как вы считаете, какой из спиртов будет иметь большую температуру кипения — глицерин или пропанол-1? А растворимость в воде?
Многоатомные спирты за счёт многочисленных ОН-групп образуют многочисленные водородные связи и друг с другом, и с водой. Поэтому они имеют бОльшие температуры кипения и бОльшую растворимость в воде по сравнению с соответствующими одноатомными спиртами. Так, глицерин — бесцветная, густая жидкость, без запаха; он смешивается с водой в любых соотношениях и способен поглощать влагу из воздуха. Более того, безводный глицерин может отнимать воду из живых клеток кожи, вызывая ожоги. Растворы глицерина, наоборот, смягчают кожу.
Химические свойства глицерина и других многоатомных спиртов очень похожи на свойства одноатомных спиртов: они реагируют с натрием и НСl, образуют эфиры, могут окисляться. Например, глицерин реагирует с азотной кислотой:
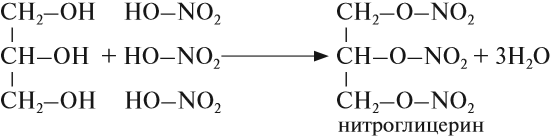
Нитроглицерин входит в состав сильнейшей взрывчатой смеси динамита. Его раствор используется как лекарство.
Но в химических свойствах многоатомных спиртов есть и существенные отличия. Так, они могут растворять осадок гидроксида меди II, образуя ярко-синий раствор:
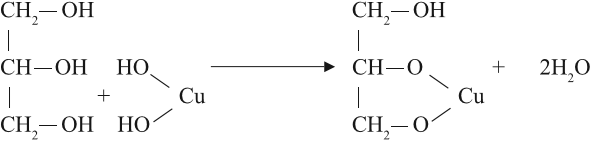
Реакция происходит при обычных условиях, причём полученное соединение очень прочное: не изменяет свой цвет даже при кипячении. Одноатомные спирты такую реакцию не дают.
Вывод. Реакция растворения голубого осадка гидроксида меди II с образованием ярко-синего раствора — этокачественная реакция на многоатомные спирты.
Реакции элиминирования (отщепления)
Дегидратация
Дегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию.
При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH3-O-CH3).
Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
а) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов:
б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов:
в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются.
Реакции окисления
Горение
Спирты легко вступают в реакцию горения. При этом образуется большое количество тепла:
2СН3-ОН + 3O2 = 2CO2 + 4H2O + Q
Неполное окисление
Неполное окисление первичных спиртов может приводить к образованию альдегидов и карбоновых кислот.
В случае неполного окисления вторичных спиртов возможно образование только кетонов.
Неполное окисление спиртов возможно при действии на них различных окислителей, например, таких, как кислород воздуха в присутствии катализаторов (металлическая медь), перманганат калия, дихромат калия и т.д.
При этом из первичных спиртов могут быть получены альдегиды. Как можно заметить, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование:
Следует отметить, что при использовании таких окислителей, как перманганат калия и дихромат калия в кислой среде возможно более глубокое окисление спиртов, а именно до карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты могут в этих условиях окислиться только до кетонов.
Предельные многоатомные спирты
Замещение атомов водорода гидроксильных групп
Многоатомные спирты так же, как и одноатомные реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от пленки Al2O3); при этом может заместиться разное число атомов водорода гидроксильных групп в молекуле спирта:
2. Поскольку в молекулах многоатомных спиртов содержится несколько гидроксильных групп, они оказывают влияние друг на друга за счет отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О-Н и повышению кислотных свойств гидроксильных групп.
Большая кислотность многоатомных спиртов проявляется в том, что многоатомные спирты, в отличие от одноатомных, реагируют с некоторым гидроксидами тяжелых металлов. Например, нужно запомнить тот факт, что свежеосажденный гидроксид меди реагирует с многоатомными спиртами с образованием ярко-синего раствора комплексного соединения.
Так, взаимодействие глицерина со свежеосажденными гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди:
Данная реакция является качественной на многоатомные спирты. Для сдачи ЕГЭ достаточно знать признаки этой реакции, а само уравнение взаимодействия уметь записывать необязательно.
3. Так же, как и одноатомные спирты, многоатомные могут вступать в реакцию этерификации, т.е. реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров. Данная реакция катализируется сильными неорганическими кислотами и является обратимой. В связи с этим при осуществлении реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье:
Если в реакцию с глицерином вступают карбоновые кислоты с большим числом атомов углерода в углеводородном радикале, получающиеся в результате такой реакции, сложные эфиры называют жирами.
В случае этерификации спиртов азотной кислотой используют так называемую нитрующую смесь, представляющую собой смесь концентрированных азотной и серной кислот. Реакцию проводят при постоянном охлаждении:
Сложный эфир глицерина и азотной кислоты, называемый тринитроглицерином, является взрывчатым веществом. Кроме того, 1%-ный раствор данного вещества в спирте обладает мощным сосудорасширяющим действием, что используется при медицинских показаниях для предотвращения приступа инсульта или инфаркта.
Замещение гидроксильных групп
Реакции данного типа протекают по механизму нуклеофильного замещения. К взаимодействиям такого рода относится реакция гликолей с галогеноводородами.
Так, например, реакция этиленгликоля с бромоводородом протекает с последовательным замещением гидроксильных групп на атомы галогена:
Состав вторичного спирта
Структуры спиртов зависят от природы групп R. Однако для вторичных спиртов можно привести некоторые примеры, учитывая, что могут быть только линейные структуры с разветвлениями или без них, или циклические структуры. Например, у вас есть следующее изображение:
Обратите внимание, что для обеих структур есть что-то общее: OH связан с буквой «V». Каждый конец V представляет собой одинаковую группу R (верхняя часть изображения, циклическая структура) или разные (нижняя часть, разветвленная цепь).
Таким образом, любой вторичный алкоголь очень легко идентифицировать, даже если его номенклатура вообще неизвестна.
Точки кипения
Свойства вторичных спиртов физически не слишком отличаются от других спиртов. Обычно это прозрачные жидкости, и чтобы они были твердыми при комнатной температуре, они должны образовывать несколько водородных связей и иметь высокую молекулярную массу.
Однако та же структурная формула R2CHOH намекает на определенные свойства, в целом уникальные для этих спиртов. Например, группа ОН менее открыта и доступна для взаимодействий водородных связей, R2CH-OH-OHCHR2.
Это связано с тем, что группы R, смежные с углеродом, несущим ОН, могут мешать и препятствовать образованию водородных связей. В результате вторичные спирты имеют более низкие температуры кипения, чем первичные спирты (RCH2ОЙ).
Обезвоживание
В этой реакции H и OH из соседних атомов углерода теряются, образуя двойную связь между этими двумя атомами углерода. Следовательно, происходит образование алкена. Реакция требует кислотного катализатора и подачи тепла.
Алкоголь => Алкен + H2ИЛИ
Например, у нас есть такая реакция:
Циклогексанол => Циклогексен + H2ИЛИ
Этерификация
Вторичный спирт реагирует с карбоновой кислотой с образованием сложного эфира. Например, показано химическое уравнение реакции втор-бутилового спирта с уксусной кислотой с образованием втор-бутилацетата:
CH3CHOHCH2CH3 + CH3COOH CH3КУХНЯ3CH2CH3
Реактивность
Спирты 3º не могут окисляться до кетонов (R2C = O) или альдегидов (RCHO) или карбоновых кислот (RCOOH). Во-первых, вам придется потерять один или два атома углерода (в виде CO2) окисляться, что снижает его реакционную способность против окисления; а с другой — ему не хватает водорода, который он может потерять, чтобы образовать еще одну связь с кислородом.
Однако они могут претерпевать замещение и отщепление (образование двойной связи, алкена или олефина).