- Концепции и немного истории
- Определение
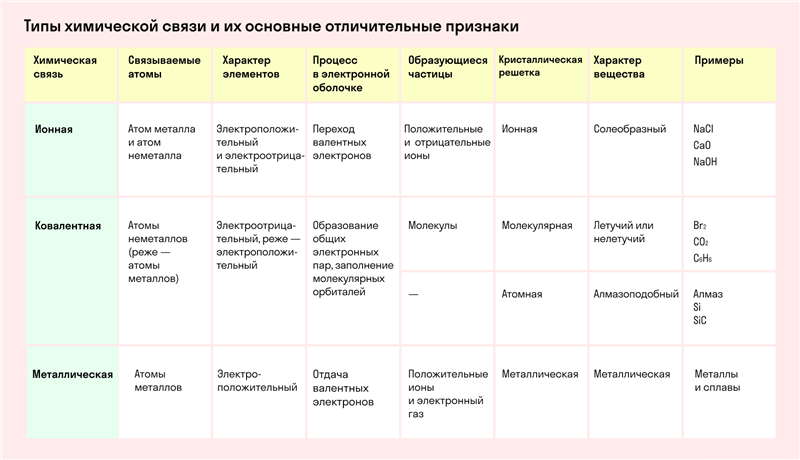
- Кратко о химических связях
- Типы связей
- Основные характеристики химической связи:
- Особенности ионной связи
- Ионная связь
- Водородная связь
- Металлическая связь
- Ковалентная связь
- Полюсное взаимодействие
- Неполярная структура
- Квалифицирование ковалентности
- Как определить вид связи
Концепции и немного истории
Валентность показывает на присутствие конкретной силы. Появление подобной связи случается через обобщение атомных электронов, у которых нет «пары». Ковалентная связь случается между атомами неметаллов и может быть замечена как в молекулах, так и в кристаллах.
В первый раз ковалентность была открыта в 1916 г. химиком из Америки Дж. Льюисом, и прошло некоторое время, пока сформировалась гипотеза, а потом её смогли обобществить, и она была доказана опытным путём. Химики узнали, что это за прецедент, при котором выявили: электроотрицательность неметаллов довольно велика, и при содействии 2-х физических атомов притягивание электронов может быть сложной задачей и даже неосуществимой, поскольку они в 2-х атомах соединяются, и между ними случается ковалентность атомов.
Определение
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
- Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
- Ковалентная неполярная связь имеет место между атомами с разной ЭО.
- Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
- Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
- Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Состав веществаЭлементы в составе веществаХимическая связьТип кристаллической решетки
| Простой | Металл | Металлическая | Металлическая |
| Неметалл с одинаковой ЭО | Ковалентная неполярная | Молекулярная или атомная | |
| Сложный | Металл и неметалл | Ионная | Ионная |
| Неметалл с разной ЭО | Ковалентная полярная | Молекулярная или атомная |
Типы связей
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
- Ковалентная химическая связь (которая в свою очередь может быть полярной и неполярной)
- Ионная связь
- Водородная связь
- Химическая связь металлов
подобных людям.
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
Основные характеристики химической связи:
- насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
- полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
- направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Особенности ионной связи
Вещества с ионной химической связью имеют ряд особенностей:
- низкая летучесть;
- высокая температура плавления;
- низкая электростатическая проводимость из-за специфического строения кристаллической решетки;
- твердость, но при этом хрупкость веществ;
- заметная растворимость соединений в полярных растворителях.
Ионная связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.
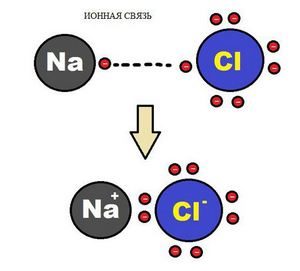
Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
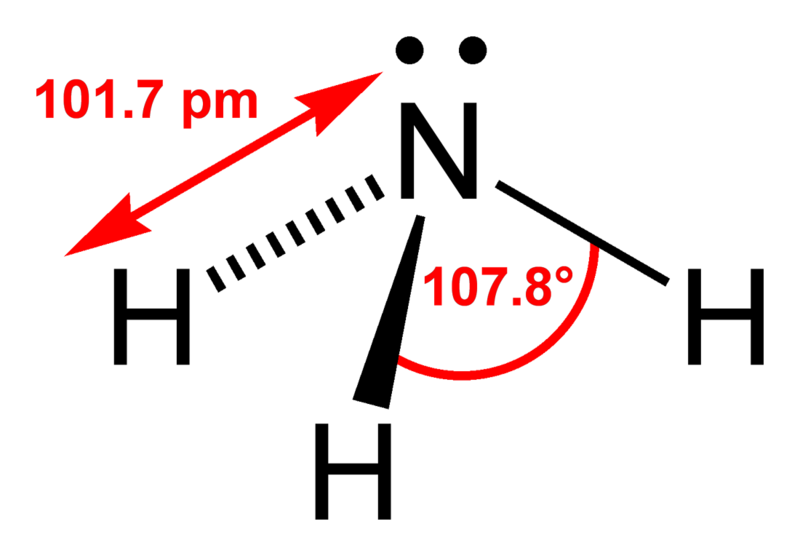
Водородная связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.
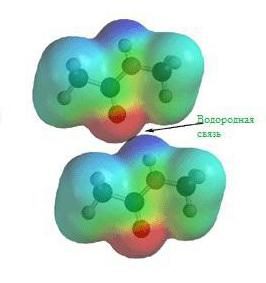
На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Металлическая связь
Данный тип связи образуется в металлах.
У атомов всех металлов на внешнем электронном слое присутствуют электроны, имеющие низкую энергию связи с ядром атома. Для большинства металлов, энергетически выгодным является процесс потери внешних электронов.
Ввиду такого слабого взаимодействия с ядром эти электроны в металлах весьма подвижны и в каждом кристалле металла непрерывно происходит следующий процесс:
М0 — ne− = Mn+ , где М0 – нейтральный атом металла, а Mn+ катион этого же металла. На рисунке ниже представлена иллюстрация происходящих процессов.
То есть по кристаллу металла «носятся» электроны, отсоединяясь от одного атома металла, образуя из него катион, присоединяясь к другому катиону, образуя нейтральный атом. Такое явление получило название “электронный ветер”, а совокупность свободных электронов в кристалле атома неметалла назвали “электронный газ”. Подобный тип взаимодействия между атомами металлов назвали металлической связью.
Ковалентная связь
Исследования, однако, показывают, что полный переход электронов от одного атома к другому происходит далеко не всегда. Очень часто химическая связь образуется не при отдаче-приёме электронов, а в результате образования общих электронных пар*. Такая связь называется ковалентной.
* Эти электронные пары возникают в месте пересечения электронных облаков.
Ковалентная связь образуется в месте перекрывания электронных облаков* обоих атомов.
* Электронное облако — область пространства, где нахождение электрона наиболее вероятно.
Такая связь образуется, например, между атомами неметаллов. Возникает вопрос: каким образом область пересечения электронных облаков может связывать атомы? Рассмотрим динамическую модель этого явления, т. е. процесс возникновения ковалентной связи. Предположим, два атома сблизились на достаточно близкое расстояние.
Вопрос. Какие силы возникли между атомами?
Поскольку вокруг ядер атомов расположены отрицательно заряженные электроны, между атомами возникают силы отталкивания. Но если атомы обладают достаточной энергией, их электронные облака перекрываются (см. рис. 17.).

В этой области пространства возникает избыточный отрицательный заряд. А ядра атомов, как известно, имеют положительный заряд. Таким образом, ядра обоих атомов притягиваются к общему отрицательному заряду, который возник благодаря пересечению электронных облаков. Поэтому:
- во-первых, область перекрывания электронных облаков является, фактически, химической связью;
- во-вторых, чем больше область перекрывания электронных облаков, тем прочнее (при прочих равных условиях) данная связь.
В месте перекрывания электронных облаков образуются общие электронные пары. Рассмотрим, как возникает ковалентная связь в молекуле азота N2. Для этого рассмотрим строение атома азота:
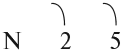
Или: N … 2s2 2р3
Вопрос. Сколько электронов не хватает до завершения внешнего уровня?
Не хватает трёх электронов. Поэтому, обозначив каждый электрон внешнего уровня точкой, получим:
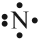
Вопрос. Почему три электрона обозначены одиночными точками?
Дело в том, что мы хотим показать образование общих пар электронов. А пара — это два электрона. Такая пара возникает, в частности, если каждый атом предоставит по одному электрону для образования каждой пары (1 + 1 = 2). Атому азота не хватает трёх электронов до завершения внешнего уровня. Значит, он должен «приготовить» три одиночных электрона для образования будущих пар.
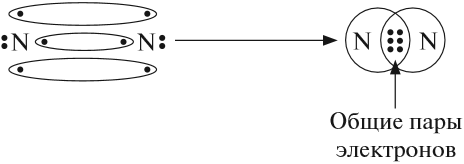
Получена электронная формула молекулы азота, при помощи которой показано, что:
- у каждого атома азота имеется теперь восемь электронов (шесть из них обведены кружочком плюс 2 электрона «собственной», неподелённой пары электронов);
- между атомами возникли 3 общие пары электронов (место пересечения кружков).
Каждая общая пара электронов соответствует одной ковалентной связи. Сколько ковалентных связей возникло? Три. Каждую связь (каждую общую пару электронов) покажем при помощи чёрточки (валентный штрих):
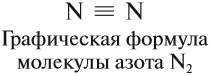
Эта графическая формула показывает, что атом азота в молекуле N2 — трёхвалентен, так как валентность — это способность атома образовывать определённое число ковалентных химических связей.
Может ли возникнуть такая связь между разными атомами? Может. Пусть атом азота взаимодействует с атомами водорода:
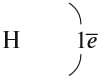
Строение атома водорода показывает, что этот атом имеет один электрон. Сколько таких атомов нужно взять, чтобы атом азота «получил» «желаемое» — три электрона? Очевидно, три атома водорода (рис. 19).
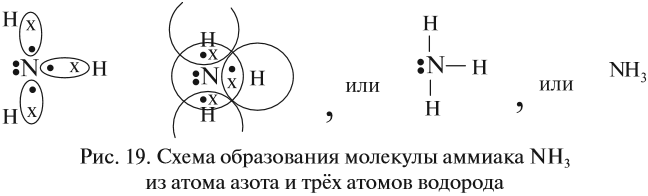
Крестиком (х) обозначены электроны атома водорода. Электронная формула молекулы аммиака показывает, что у атома азота стало восемь электронов, а у каждого атома водорода получилось по два электрона (а больше на первом энергетическом уровне и быть не может).
Графическая формула показывает, что атом азота имеет валентность три (три чёрточки, или три валентных штриха), а каждый атом водорода — валентность один (по одной чёрточке).
Значит, атом азота в этих молекулах (N2 и NН3) трёхвалентен. Поскольку пара электронов может образовываться из неспаренных электронов обоих атомов, то валентность атома часто соответствует числу неспаренных электронов. Например, в атоме азота 3 неспаренных электрона, поэтому валентность атома азота (в молекуле азота) равна III.
Казалось бы, атом азота не может иметь бОльшую валентность, так как в образовании химической связи задействованы все неспаренные электроны. Но у атома азота осталась «лишняя» неподелённая пара электронов, которая не участвовала в образовании ковалентных связей.
Если ковалентная связь образуется с участием атома, который имеет «собственную» пару электронов (2), то второй атом должен иметь свободную орбиталь (0):
В этом случае атом, имеющий пару электронов (донор), передаёт её на свободную орбиталь второго атома (акцептора). Рассмотрим механизм образования ковалентной связи по донорно-акцепторному механизму:
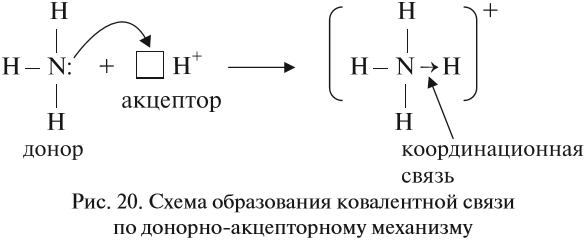
В полученном катионе аммония валентность атома азота равна IV.
Отметим, что валентность IV для атома азота — максимально возможная. Дело в том, что ковалентные связи образуются за счёт пересечения электронных облаков. А сколько таких электронных облаков в атоме азота? Четыре (одно s— и три р-облака). Поэтому и образуются 4 ковалентные связи. И не больше!
Ковалентная связь может быть полярной и неполярной. Полярность ковалентной связи определяется электроотрицательностью атомов её образующих. Электроотрицательность — способность атома смещать к себе общую пару электронов. Максимальную электроотрицательность (ЭО) имеет фтор 4,1. Далее значение ЭО уменьшается в ряду:
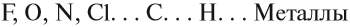
Хотя в состав обеих молекул N2 и NН3 входит один и тот же атом азота, химические связи между атомами отличаются друг от друга. В молекуле азота N2 химические связи образуют одинаковые атомы, поэтому общие пары электронов находятся посередине между атомами. Атомы сохраняют нейтральный характер. Такая химическая связь называется неполярной.
В молекуле аммиака NH3 химическую связь образуют разные атомы. Поэтому один из атомов (в данном случае — атом азота) сильнее притягивает общую пару электронов, так как имеет бОльшую ЭО. Общие пары электронов смещаются в сторону атома азота, и на нём возникает небольшой отрицательный заряд, а на атоме водорода — положительный (рис. 21).

Полюсное взаимодействие
Когда в соединении совместно есть металл и неметалл, выявляется, что элементы образуют ионное соединение. Ковалентная полярность связывает решётку атомов всевозможных неметаллов друг с другом.
Это бывают атомы:
- хлора и водорода;
- фосфора и кислорода;
- аммиака.
Есть другое определение таких веществ. Это говорит о том, что кратная цепь возникает между неметаллами с разными показателями электроотрицательного появления. В 2-х случаях возможно выделить многообразие атомов, где была замечена эта связь.
Выставленные соединения в нормальных критериях наличествуют в водянистом или же газообразном агрегатном состоянии. Формулы Дж. Льюиса могут помочь понять устройство и насыщаемость связывания атомных ядер.
Действие получения ковалентности для атомов с разными значениями электроотрицательности объединяется к образованию совместной плотности электрического состояния. Как правило, он сдвинут к составляющей, что содержит самую возвышенную степень электроотрицательности. По причине возникающего смещения всей пары в направленности вещества с большим числом электроотрицательности в нём отчасти появляется негативный заряд. Вследствие этого, появляется слияние с 2-мя по-разному заряженными полюсами. Нередко при формировании полярных отношений применяется акцепторный или же донорно-акцепторный механизм.
Путь образования ковалентных связей:
- Акцепторный (обмена). Любой атом выделяет 1 неспаренный электрон.
- Донорно-акцепторный ковалентный тип. Один атом (донор) гарантирует электрическую пару, а акцептор орбиталь для неё.
Устройство образования ковалентных связей описывается как конфигурация взаимодействия, свойственная не для всех полярных соединений. Примерами считаются вещества органического и неорганического происхождения.
Неполярная структура
Неполярная ковалентность связывает составляющие с неметаллическими качествами, что точно так же равно электроотрицательному значению. Другими словами, элементы с неполярностью предполагают собой соединения, состоящие из различных чисел похожих неметаллов. Формула вещества с ковалентной неполярной связью: N2.
Примером ковалентной неполярной связи считаются вещества простой структуры: О2, N2, Cl2. Составление этого типа взаимодействия и других неметаллических частей включает экстремальные электроны. Валентность относится к количеству электронов, важных для окончания обычной наружной оболочки. Атом имеет возможность предоставить или же получить негативно заряженные частички.
Эта работа относится к уровню двухэлектронных или же двухцентровых цепей. В этом случае пара электронов занимает общую долю между 2-мя орбиталями. В структурных формулах пара электронов записывается в виде части по горизонтали. Каждая связь демонстрирует количество общих пар электронов в молекуле. Потребуется затратить наибольшее число энергии для разрушения с помощью этой связи, вследствие чего эти вещества станут одними из самых мощных по шкале крепости.
По донорно-акцепторному механизму неполярные части буквально не связаны. Ковалентная неполярная связь представляет собой структуру, образующуюся совместными электронными парами. Эти пары в равной степени принадлежат 2 атомам.
Однообразие ковалентных неполярных и полярных связей заключается в возникновении абсолютной электрической плотности. Лишь только в ином случае приобретённые электрические совместные части в равной степени принадлежат 2 атомам, занимающим центральное состояние. В итоге выборочные положительные и отрицательные заряды не образуются, что значит полученные цепочки считаются неполярными.
Неполярность приводит к образованию совместной пары, в итоге конечная степень атома будет законченной. Качества этих веществ, имеющих определённые структуры, выделяются от тех, что с металлическими или же ионными взаимодействиями. В обменном процессе ковалентности между атомами любой из них представляет собой один неспаренный электрон, образующий электрическую ковалентность. В этом случае они могут иметь обратные заряды.
Случаем подобной ковалентной связи могут быть взаимодействия, которые видятся в молекуле водорода. Когда атомы вещества намереваются совместно действовать, их электрические части попадают друг в друга. В итоге плотность между ядрами возрастает, они сами притягиваются, а энергия системы миниатюризируется. Впрочем, в случае если ядра делаются очень близкими, они начинают отталкиваться, и, таким образом, между ними появляется подходящее расстояние.
Что касается донорно-акцепторного вида ковалентности, то это случается, когда 1 из частиц, донор, предположит собственную электрическую пару для связи, а 2-я, акцептор, считается свободной орбиталью.
Квалифицирование ковалентности
Смысл ковалентной неполярной связи такой — это взаимодействие, которое появляется между похожими атомами. В молекулах с неполярной ковалентностью совместные пары электронов находятся на равных расстояниях от атомных ядер. К примеру, в молекуле воздуха атомы имеют 8 электрических конфигураций, в то время как они имеют 4 совместные электрические пары. Препараты с неполярной ковалентностью, как правило, предполагают собой газы, воду или же сравнительно низколегированные твёрдые вещества.
Чтобы верно квалифицировать ковалентную полярную и неполярную связь, достаточно понять свойство и формулу молекул, в случае, если они состоят из атомов различных составляющих, взаимодействие будет полярным, а если из 1-го, то станет неполярным. Ещё надо знать, что неполярные связи в целом могут встречаться лишь только между неметаллами, и это связано с механизмом ковалентных взаимодействий.
Как определить вид связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.