- Что из себя представляет серная кислота
- Исторические сведения
- Физические и физико-химические свойства
- Олеум
- Химические свойства серной кислоты
- Примеры взаимодействия серной кислоты с простыми веществами:
- Примеры взаимодействия серной кислоты со сложными веществами:
- Получение серной кислоты
- Промышленное производство серной кислоты (контактный способ):
- Нитрозный (башенный) способ
- Другой способ
- Применение в народном хозяйстве
- Токсическое действие
- Факты о серной кислоте
- Дополнительные сведения
- Стандарты
- Примеры решения задач
Что из себя представляет серная кислота
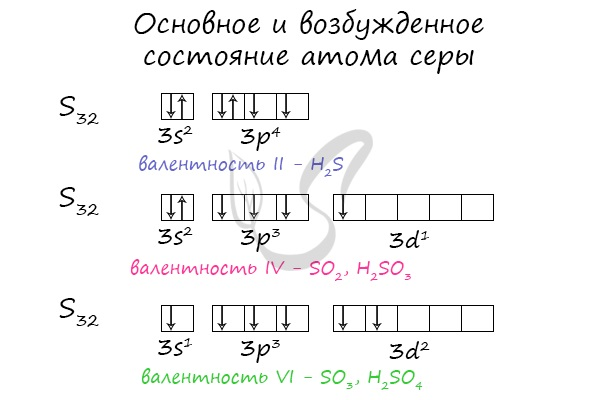
Серная кислота является сильной кислотой, двухосновной, устойчивой и нелетучей.
В стандартных условиях серная кислота представляет собой тяжелую маслянистую жидкость. Вещество отличается хорошей растворимостью в воде.
Молекула серной кислоты включает в себя:
- четыре атома кислорода;
- два атома водорода;
- один атом серы.
Жидкость токсична, не имеет запаха. Кислота в чистом состоянии бесцветная, обладает специфическим «медным» привкусом, плотность составляет 1,84 г/см3. Из-за примесей вещество приобретает желтоватую или буро-желтую окраску. В зависимости от концентрации различают:
- разбавленную H2SO4 в виде водного раствора с процентным содержанием H2SO4 не более 70%;
- концентрированную H2SO4 в виде водного раствора с концентрацией H2SO4 более 70%.
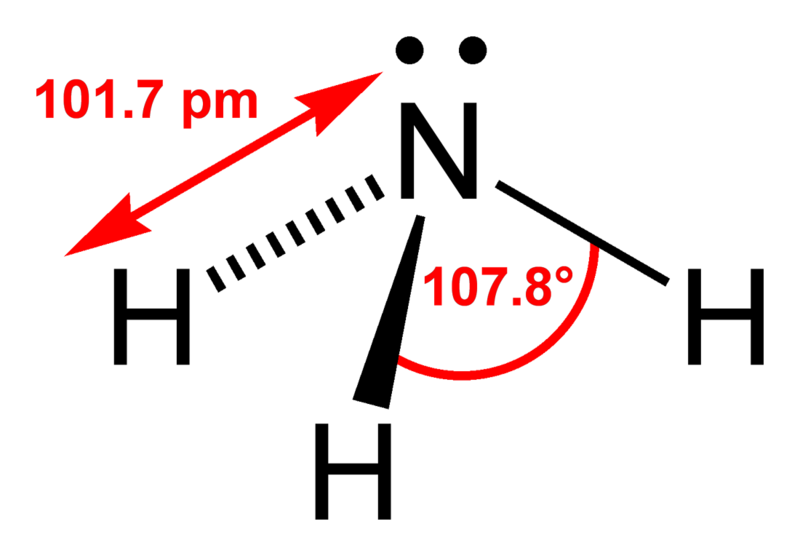
Молекула серной кислоты обладает формой, близкой к тетраэдрической (атом серы располагается в центре, атомы кислорода — в вершинах тетраэдра):
Исторические сведения
Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Схема получения серной кислоты из железного купороса — термическое разложение сульфата железа (II) с последующим охлаждением смеси.
В трудах алхимика Валентина (XIII в) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ просуществовал вплоть до 1955 г.
Алхимикам XV века в известен был также способ получения серной кислоты из пирита — серного колчедана, более дешёвого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума.
В России производство серной кислоты впервые было организовано в 1805 году под Москвой в Звенигородском уезде. В 1913 году Россия по производству серной кислоты занимала 13 место в мире.
Физические и физико-химические свойства
Очень сильная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2О с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4− — 0,18, H3SO4+ — 0,14, H3O+ — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H+, HSO4−, и SO₄2−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Температура кипения водных растворов серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H2SO4.
Свойства водных растворов серной кислоты и олеумаСодержание % по массеПлотность при 20 ℃, г/см³ Температура плавления, ℃ Температура кипения, ℃H2SO4SO3 (свободный)
| 10 | — | 1,0661 | −5,5 | 102,0 |
| 20 | — | 1,1394 | −19,0 | 104,4 |
| 40 | — | 1,3028 | −65,2 | 113,9 |
| 60 | — | 1,4983 | −25,8 | 141,8 |
| 80 | — | 1,7272 | −3,0 | 210,2 |
| 98 | — | 1,8365 | 0,1 | 332,4 |
| 100 | — | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме, общее давление пара над ним повышается. Максимальную вязкость имеет олеум H₂SO₄·SO₃, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO₃ и 92 % H₂SO₄ и максимально при концентрации 84 и 99,8 % H₂SO. Для олеума минимальное ρ при концентрации 10 % SO₃. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Химические свойства серной кислоты
- При взаимодействии H2SO4(конц.) со слабыми восстановителями (неметаллами: S, P, C, средне- и малоактивными металлами: Fe, Cu, Ag, сложными веществами: H2S, сульфидами металлов, солями Fe2+ и т.д.) образуются SO2 и H2O.
- При взаимодействии H2SO4(конц.) с сильными восстановителями (активными металлами: Li-Zn, некоторыми сложными веществами: HI, KI) образуются H2S или S.
Примеры взаимодействия серной кислоты с простыми веществами:
4Zn + 5H2SO4(конц.) → 4ZnSO4 + H2S
+ 4H2O (возможно образование SO2 и S, так как Zn — хороший восстановитель)
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2
+ 6H2O (только при нагревании)
Al, Cr, Fe пассивируются холодной концентрированной серной кислотой (т.е. покрываются оксидной пленкой, препятствующей дальнейшей реакции). Реакции идут только при нагревании.
Концентрированная серная кислота окисляет даже слабые металлы, но кроме золота и платины, например:
2Ag + 2H2SO4(конц.) → Ag2SO4 + SO2
+ 2H2O
В реакциях с неметаллами образуются соответствующие кислоты:
C + H2SO4(конц.) → CO2 + 2SO2
+ 2H2O (t)
S + H2SO4(конц.) → 3SO2
+ 2H2O (t)
2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2
+ 2H2O (t)
Примеры взаимодействия серной кислоты со сложными веществами:
Из галогеноводородов концентрированная серная кислота может окислить только ионы Br– и I– :
HF + H2SO4(конц.) → реакция не идет
HCl + H2SO4(конц.) → реакция не идет
2HBr + H2SO4(конц.) → Br2 + SO2
+ 2H2O
8HI + H2SO4(конц.) → 4I2 + H2S
+ 4H2O
2CuI + 4H2SO4(конц.) → 2CuSO4 + I2 + 2SO2
+ 4H2O
2CrCl2 + 4H2SO4(конц.) → Cr2(SO4)3 + SO2
+ 4HCl + 2H2O
Соли меди восстанавливают серную кислоту до SO2, тогда как соли активных металлов до H2S, так как последние проявляют более выраженные восстановительные свойства:
2CuI + 4H2SO4(конц.) → 2CuSO4 + I2 + 2SO2
+ 4H2O
8KI + 5H2SO4(конц.) → 4K2SO4 + 4I2 + H2S
+ 4H2O
Примеры реакций с солями (окисляем катион):
2FeSO4 + 2H2SO4(конц.) → Fe2(SO4)3 + SO2
+ 2H2O
2CrCl2 + 4H2SO4(конц.) → Cr2(SO4)3 + SO2
+ 4HCl + 2H2O
Получение серной кислоты
Промышленное производство серной кислоты (контактный способ):
1) 4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2
2) 2SO 2 + O 2 V 2 O 5 → 2SO 3
3) nSO 3 + H 2 SO 4 → H 2 SO 4 ·nSO 3 (олеум)
Измельчённый очищенный влажный пирит (серный колчедан) сверху засыпают в печь для обжига в « кипящем слое «. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом.
Из печи выходит печной газ, состав которого: SO 2 , O 2 , пары воды (пирит был влажный) и мельчайшие частицы огарка (оксида железа). Газ очищают от примесей твёрдых частиц (в циклоне и электрофильтре) и паров воды (в сушильной башне).
В контактном аппарате происходит окисление сернистого газа с использованием катализатора V 2 O 5 ( пятиокись ванадия) для увеличения скорости реакции. Процесс окисления одного оксида в другой является обратимым. Поэтому подбирают оптимальные условия протекания прямой реакции — повышенное давление (т.к прямая реакция идет с уменьшением общего объема) и температура не выше 500 С ( т.к реакция экзотермическая).
В поглотительной башне происходит поглощение оксида серы (VI) концентрированной серной кислотой.
Поглощение водой не используют, т.к оксид серы растворяется в воде с выделением большого количества теплоты, поэтому образующаяся серная кислота закипает и превращается в пар. Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H 2 SO 4 ·nSO 3
Нитрозный (башенный) способ
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
SO2 + NO2 + H2O = H2SO4 + NO ↑
Другой способ
В тех редких случаях, когда сероводород (H2S) вытесняет сульфат(SO4-) из соли (с металлами Cu,Ag,Pb,Hg) побочным продуктом является серная кислота
H2S + CuSO4 = CuS + H2SO4
Сульфиды данных металлов обладают высочайшей прочностью, а также отличительным чёрным окрасом,
но могут быть окислены до сульфатов, например, азотной кислотой при кипении:
CuS + 8HNO3 → CuSO4 + 8NO2↑ + 4H2O
Применение в народном хозяйстве
Достижения химии всегда служили научно-техническому прогрессу. Высокие окислительные способности позволили H2SO4 стать важным компонентом в ряде отраслей промышленности. Её используют:
- добыча редких элементов (очистка урановых, иридиевых, циркониевых и осмиевых руд);
- производство минеральных удобрений, высокомолекулярных нитей, красок и пиротехники;
- неорганический синтез солей и кислот;
- текстильная и кожевенная отрасли;
- нефтехимия и металлообработка;
- пищевая промышленность (добавка-эмульгатор E513);
- автомобилестроение (электролит в аккумуляторах);
- дистиллирование воды (реагент для восстановления смол в фильтрах).
Отдельно стоит упомянуть промышленный органический синтез — источник эфиров и спиртов, синтетических моющих средств и искусственных волокон. Он немыслим реакций дегидратации, гидратации, сульфирования, алкилирования. Металлообрабатывающие заводы очищают поверхности изделий от окислов, образующихся при сильном нагревании. Но основным потребительским сегментом является изготовление минеральных удобрений (больше всего — фосфорных). Из-за этого сернокислотные заводы рекомендуется размещать недалеко от предприятий по производству этих ценных химических продуктов.
Все приведённые положительные характеристики были бы неполными, если не вспомнить, что серная кислота и олеум — опасные, чрезвычайно агрессивные продукты. Атмосферные кислотные аэрозоли периодически образуются в результате выбросов металлургических и химических заводов и выпадают в виде осадков. Они поражают кожу и слизистые, что приводит к затруднению дыхания, провоцирует кашель и бронхолёгочные заболевания с отёками гортани.
При попадании на кожные покровы возникают химические ожоги, их тяжесть напрямую зависит от концентрации и площади контакта. При проглатывании появляются резкие боли во рту и пищеводе, затем начинается рвота, кашель, затрудняется дыхание и ослабляется сердечная деятельность, а смертельной считается доза 5 мг. Первая помощь при отравлении парами заключается в обеспечении притока свежего воздуха и промывании слизистых содовым раствором. При растекании по коже поражённое место обильно орошают водой, а проглатывание требует промывания желудка и приёма известковой воды.
Токсическое действие
Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
В РФ оборот серной кислоты концентрации 45% и более — ограничен.
Факты о серной кислоте
Вот некоторые факты о серной кислоте, которые дадут вам дополнительное представление об этой едкой, опасной, но важной кислоте.
Молярная масса серной кислоты составляет 98,08 г / моль. Это рассчитывается в соответствии с атомными массами его атомов: два атома водорода (2 х 1,008 г / моль), один атом серы (1 х 32,065 г / моль) и четыре атома кислорода (4 х 16 г / моль). Для общего веса одной молекулы серной кислоты расчет такой же, но результаты приведены в аму или единицах атомной массы. Именно когда вы хотите знать молекулярную массу более чем одного моля, результат молекулярной массы отличается от молярной массы. Например, когда у вас есть 2 грамма диоксида серы (SO2 с молярной массой 64,065 г / моль) и вы хотите знать, сколько это молей. Чтобы рассчитать этот результат, сначала нужно разделить 1 (моль) с молярной массой вещества. Затем вы умножаете результат на 2 (граммы), как показано в приведенном ниже уравнении.
Плотность серной кислоты зависит от ее силы (концентрации) и температуры. Например, 13% раствор H2SO4 при комнатной температуре имеет плотность 9,09 г / см3. 96% раствор при той же температуре имеет плотность 15,37 г / см3. Температура кипения серной кислоты составляет 639 ° F, 337 ° C или 610 К; температура замерзания составляет 37 ° F, а температура плавления – 50 ° F.
Дополнительные сведения
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
Стандарты
- Кислота серная техническая ГОСТ 2184-77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667-73
- Кислота серная особой чистоты. Технические условия ГОСТ 14262-78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204-77
Примеры решения задач
ПРИМЕР 1
| Задание | Определите массу серной кислоты, которую можно получить из одной тонны пирита, если выход оксида серы (IV) в реакции обжига составляет 90%, а оксида серы (VI) в реакции каталитического окисления серы (IV) – 95% от теоретического. |
| Решение | Запишем уравнение реакции обжига пирита: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2. Рассчитаем количество вещества пирита: n(FeS2) = m(FeS2) / M(FeS2); M(FeS2) = Ar(Fe) + 2×Ar(S) = 56 + 2×32 = 120г/моль; n(FeS2) = 1000 кг / 120 = 8,33 кмоль. Поскольку в уравнении реакции коэффициент при диоксиде серы в два раза больше, чем коэффициент при FeS2, то теоретически возможное количество вещества оксида серы (IV) равно: n(SO2)theor = 2 ×n(FeS2) = 2 ×8,33 = 16,66 кмоль. А практически полученное количество моль оксида серы (IV) составляет: n(SO2)pract = η × n(SO2)theor = 0,9 × 16,66 = 15 кмоль. Запишем уравнение реакции окисления оксида серы (IV) до оксида серы (VI): 2SO2 + O2 = 2SO3. Теоретически возможное количество вещества оксида серы (VI) равно: n(SO3)theor = n(SO2)pract = 15 кмоль. А практически полученное количество моль оксида серы (VI) составляет: n(SO3)pract = η × n(SO3)theor = 0,5 × 15 = 14,25 кмоль. Запишем уравнение реакции получения серной кислоты: SO3 + H2O = H2SO4. Найдем количество вещества серной кислоты: n(H2SO4) = n(SO3)pract = 14,25 кмоль. Выход реакции составляет 100%. Масса серной кислоты равна: m(H2SO4) = n(H2SO4) × M(H2SO4); M(H2SO4) = 2×Ar(H) + Ar(S) + 4×Ar(O) = 2×1 + 32 + 4×16 = 98 г/моль; m(H2SO4) = 14,25 × 98 = 1397 кг. |
| Ответ | Масса серной кислоты равна 1397 кг |