- Основные положения теории электролитической диссоциации
- История вопроса
- Виды электролитов
- Кажущаяся степень диссоциации.
- Электролиты и неэлектролиты
- Степень диссоциации
- Ступенчатая диссоциация
- Пример 1
- Пример 2
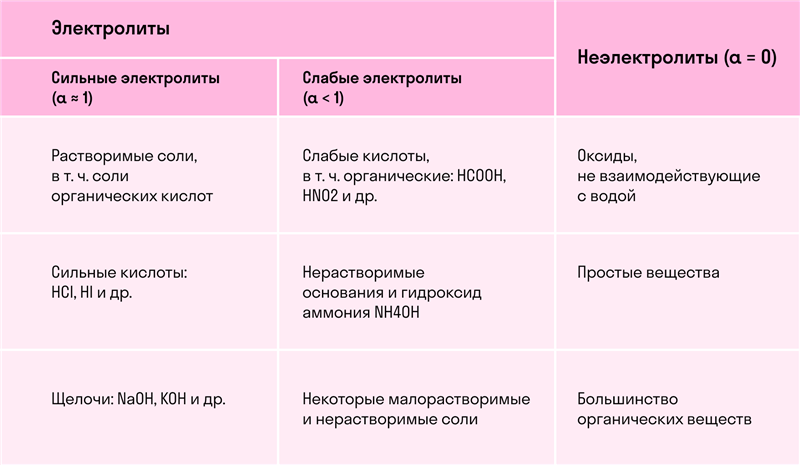
- Сильные и слабые электролиты
- Как определить сильный и слабый электролит?
- Уравнение диссоциации
- Противостояние титанов
- Определение сильных и слабых, как распознать
- Свойства растворов электролитов
Основные положения теории электролитической диссоциации
- Химические субстанции делятся на электролиты — вещества, которые проводят электрический ток, и неэлектролиты. К электролитам относится большинство сложных неорганических веществ: кислоты, основания, соли.
К неэлектролитам — большинство органических веществ. - В воде электролиты распадаются на ионы: положительно заряженные катионы и отрицательно заряженные анионы. Ионы бывают простые и сложные. В растворе ионы находятся в хаотическом движении.
- Под действием электрического тока движение ионов упорядочивается, и катионы движутся к отрицательному полюсу — катоду, анионы к положительному аноду.
- На степень электролитической диссоциации влияют различные факторы: природа растворенного вещества и его количество, свойства растворителя, температура раствора.

Химия. 8 класс. Учебник Учебник написан преподавателями химического факультета МГУ имени М.В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать ее в классах и школах с углубленным изучением естественно-научных предметов. Купить
История вопроса
Изучение растворов с давних времен занимало умы исследователей. В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток. Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация. Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и в наше время пользуются дворники, щедро посыпая солью обледеневшие тротуары. Однако, температура замерзания электролитов не соответствовала расчетным данным.
Научным несостыковкам требовалось найти объяснение. И молодой, 29-летний шведский ученый С. Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Виды электролитов
Электролитическая диссоциация характеризуется степенью диссоциации. Это величина, отражающая отношение числа распавшихся молекул к общему количеству молекул вещества. Степень диссоциация показывает долю молекул вещества, распавшихся на ионы. Выражается формулой
α = n/N,
где n – количество распавшихся молекул, N – общее количество молекул.
По степени диссоциации выделяют две группы электролитов:
- сильные – распадаются практически полностью в ненасыщенных растворах (сильные кислоты, соли, щёлочи);
- слабые – распадаются частично или не распадаются (слабые кислоты, малорастворимые соли, нерастворимые основания, гидроксид аммония).
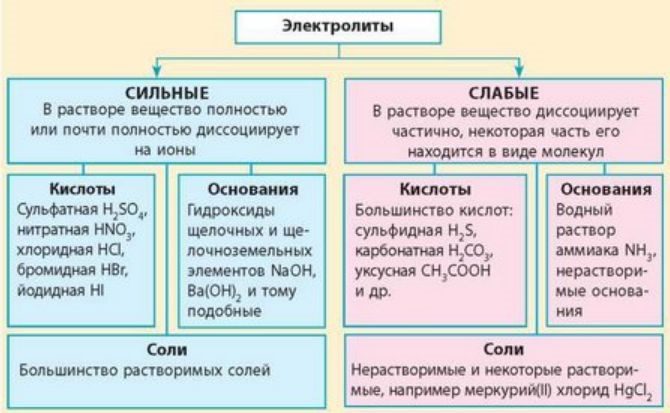
Рис. 3. Сильные и слабые электролиты.
Ненасыщенный раствор содержит небольшую концентрацию растворённого вещества. Это значит, в раствор можно добавить ещё некоторое количество вещества.
Кажущаяся степень диссоциации.
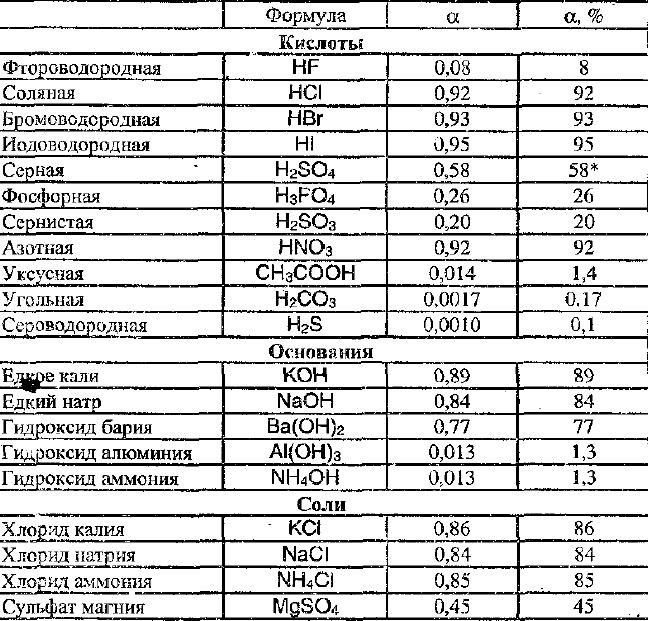
Степень диссоциации зависит не только от природы растворителя и растворяемого вещества, но и от концентрации раствора и температуры.
Уравнение диссоциации можно представить в следующем виде:
AK ⇄ A- + K+.
И степень диссоциации можно выразить так:
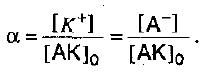
С увеличением концентрации раствора степень диссоциации электролита падает. Т.е. значения степени для конкретного электролита не является величиной постоянной.
Так как диссоциация – процесс обратимый, то уравнения скоростей реакции можно записать следующим образом:
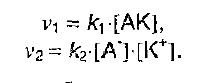
Если диссоциация равновесна, то скорости равны и в результате получаем константу равновесия (константу диссоциации):
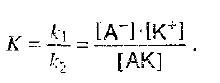
К зависит от природы растворителя и от температуры, но не зависит от концентрации растворов. Из уравнения видно, что чем больше недиссоциированных молекул, тем меньше величина константы диссоциации электролита.
Многоосновные кислоты диссоциируют ступенчато, и каждая ступень имеет свое значение константы диссоциации.
Если диссоциирует многоосновная кислота, то легче всего отщепляется первый протон, а при возрастании заряда аниона, притяжение возрастает, и поэтому протон отщепляется намного труднее. Например,
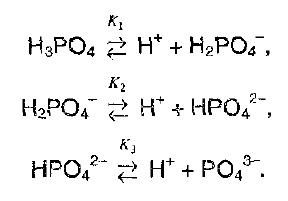
Константы диссоциации ортофосфорной кислоты на каждой ступени должны сильно различаться:
I – стадия:
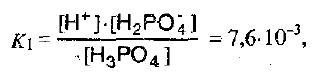
II – стадия:
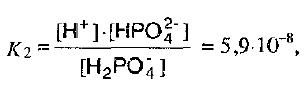
III – стадия:
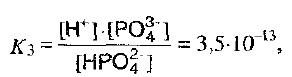
На первой ступени ортофосфорная кислота – кислота средней силы, а 2ой – слабая, на 3ей – очень слабая.
Примеры констант равновесия для некоторых растворов электролитов.

Рассмотрим пример:
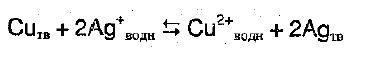
Если в раствор, в котором содержатся ионы серебра внести металлическую медь, то в момент равновесия, концентрация ионов меди должна быть больше, чем концентрация серебра.
Но у константы низкое значение:
AgCl⇄Ag++Cl-.
Что говорит о том, что к моменту достижения равновесия растворилось очень мало хлорида серебра.
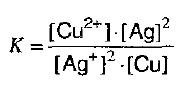
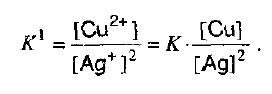
Концентрация металлической меди и серебра введены в константу равновесия.
Электролиты и неэлектролиты
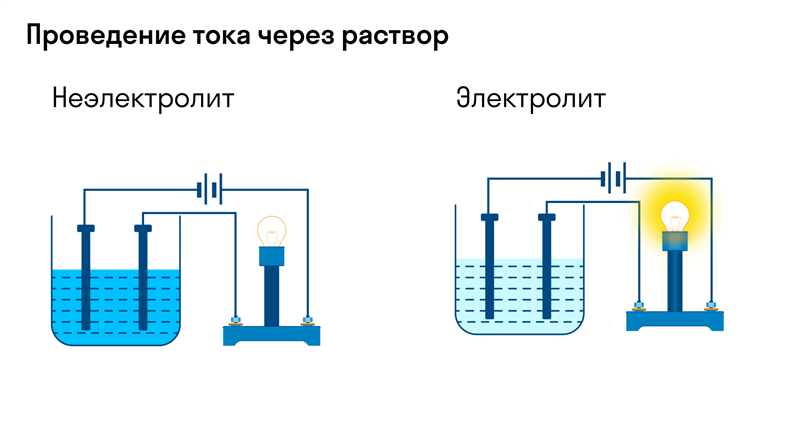
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
или .
Если в растворе на ионы распадаются все 100% электролита, .
По силе электролиты делятся на следующие группы:
- слабые — ;
- средние — ;
- сильные — .
Важно! Молекулы сильных электролитов необратимо распадаются на ионы, поэтому в уравнениях нужно ставить знак =. Реакции со слабыми электролитами обратимы, поэтому ставится знак ⇄.
Ступенчатая диссоциация
В отдельных случаях вещества расщепляются на ионы в несколько этапов или ступеней. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот. Ступенчатая диссоциация может включать два этапа и более, при этом на первой ступени концентрация ионов всегда больше, чем на последующих.
Пример 1
Ортофосфорная кислота диссоциирует в 3 ступени. На первой из них наблюдается максимальная концентрация дигидрофосфат-ионов, а на последней остается минимальное количество фосфат-ионов (диссоциация почти не идет). Данная кислота не относится к сильным электролитам, поэтому реакция обратима.
- H3PO4 ⇄ H+ + H2PO4-
- H2PO4- ⇄ H+ + HPO42-
- HPO42- ⇄ H+ + PO43-
Суммарное уравнение: H3PO4 ⇄ 3H+ + PO43-.
Пример 2
Кислая соль Ca(HCO3)2 диссоциирует в 3 ступени. Поскольку это сильный электролит, на первом этапе реакция необратима. На втором этапе распадается на ионы слабый кислотный остаток HCO3- и слабый электролит, поэтому реакция обратима.
- Ca(HCO3)2 = Ca2+ + 2HCO3-
- HCO3- ⇄ H+ + CO32-
- H+ + H2O = H3O+
Суммарное уравнение: Ca(HCO3)2 + 2H2O = Ca2+ + 2H3O+ + 2CO32-.
Сильные и слабые электролиты
Сильные электролиты быстро и полностью ионизируются при растворении, и в растворе не образуются нейтральные молекулы. Примеры сильных электролитов:
- NaCl (хлорид натрия),
- HNO3 (азотная кислота),
- HClO3 (хлорноватая кислота),
- CaCl2 (хлорид кальция) и др.
У слабых электролитов при растворении в воде ионизируются лишь небольшие фракции молекул, т.е. в их растворах присутствует некое количество нейтральных молекул. Примеры слабых электролитов:
- большинство органических кислот и оснований,
- NH4OH (аммиак),
- H2CO3 (угольная кислота),
- CH3COOH (уксусная кислота), и др.
Как определить сильный и слабый электролит?
Сильные электролиты полностью ионизируются, т.к. основными компонентами раствора сильных электролитов являются ионы, и степень диссоциации такого электролита стремится к 1 (т.е. степень диссоциации α ≈ 1). Слабые электролиты ионизируются только частично, т.е. степень диссоциации такого электролита стремится к 0 (или α < 1).
В таблице растворимости можно посмотреть степень диссоциации электролита.
Сильные электролиты:
- растворимые соли,
- многие неорганические кислоты,
- основания щелочных и щелочноземельных металлов.
Слабые электролиты:
- почти все органические кислоты и вода,
- некоторые неорганические кислоты,
- нерастворимые гидроксиды металлов.
Уравнение диссоциации
Уравнение электролитической диссоциации используют для записи процессов, происходящих в растворе.
Диссоциация сильного электролита протекает практически необратимо, что показывает стрелка →.
NaCl → Na+ + Cl-
CaCl2 → Ca2+ + 2Cl-
Диссоциация слабого электролита — обратимый процесс, протекает не полностью и не до конца, что обозначает стрелка ⇄
СH3COOH ⇄ СH3COO- + H+
Умение составлять уравнения диссоциации будет отличным подспорьем при разборе темы «§ 13. Реакции ионного обмена и условия их протекания» в учебнике под редакцией В.В. Еремина и для решения ионных уравнений.
Противостояние титанов
Теория электролитической диссоциации Аррениуса вызвала жаркие споры среди ученых.
Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что распад на ионы происходит без какого-либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Сторонники «химической», или гидратной, теории, автором которой был Д.И. Менделеев, считали, что в растворе происходит взаимодействие растворенного вещества и растворителя.
Много копий было сломано в этой борьбе. Проявились худшие человеческие качества. Так, Аррениус, пользуясь служебным положением (в 1905 году он был назначен директором физико-химического Нобелевского института в Стокгольме), приложил массу усилий, чтобы, несмотря на трехкратную номинацию на получение Нобелевской премии в 1905, 1906 и 1907 годах, Д.И. Менделеев так ее и не получил.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитическая, или протонная, теория кислот и оснований.
Определение сильных и слабых, как распознать
Аррениус является автором теории электролитической диссоциации. Под этим понятием подразумевается процесс, при котором вещество распадается на отдельные ионы. Степень диссоциации зависит от характера электролита и вычисляется по формуле:
α=(N дис)/(N общ)×100 %
Краткий вид формулы:
α=(N дис)/(N общ)
Если этот показатель превышает 30% (или 0,3), то электролит считается сильным. В уравнении их распада ставится знак «→», поскольку процесс необратимый. К подобным относятся:
- соли: NaHCO3 → Na+ + HCO3-
- сильные кислоты: H2SO4 → H+ + HSO4-
- сильные основания (щёлочи): KOH → K+ + OH-
Если степень диссоциации меньше 3% (или 0,03), то такие электролиты называют слабыми. Реакции с ними обратимы, поэтому используется знак «⇄» или «↔». К подобным относятся:
- вода: H2O ↔ H+ + OH-
- слабые и органические кислоты: H3PO4 ↔ H+ + H2PO4-
- нерастворимые основания: Fe(OH)2 ↔ FeOH+ + OH-
Свойства растворов электролитов
- электропроводность является главной характеристикой растворов электролитов;
- степень распада на ионы увеличивается при уменьшении концентрации раствора (разбавлении);
- степень диссоциации возрастает при нагревании раствора.