- Сера – химический элемент и простое вещество
- История и происхождение названия
- История открытия
- Происхождение названия
- Сера в природе
- Природные минералы серы
- Строение атома серы
- Свойства
- Физические свойства
- Химические свойства
- Фазовая диаграмма серы
- Получение и применение серы
- Биологическая роль
- Биологическое действие
- Пожароопасные свойства серы
- Пожары на складах серы
- Примеры решения задач
Сера – химический элемент и простое вещество
Сера – химический элемент главной подгруппы VI группы периодической системы элементов.
Эту подгруппу ещё называют халькогены. Название это произошло от двух греческих слов – «халькос», что в разных переводах значит «медь» или «руда», и «генос» – «рождаю».
Кислород и сера – это элементы, которые входят в состав многих руд металлов.
Русское слово «сера» восходит к старославянским корням, которые обозначали горючие вещества, смолы.
Латинское sulfur скорее всего произошло от индоевропейского swelp– «гореть».
Сера с древних времён использовалась жрецами храмов при проведении обрядов – она считалась произведением существ из мира духов.
Ещё в Древней Греции сера использовалась в военных действиях – она входила в состав знаменитого «греческого огня».
Алхимики считали серу отцом всех металлов – и теперь мы с вами знаем причину: большинство металлических руд представляют собой именно сульфиды.
На внешнем электронном слое серы шесть электронов, из них два – неспаренных, поэтому сера может принимать два электрона, проявляя степень окисления –2, выступая окислителем.
Но за счёт распаривания остальных четырех электронов на 3d-подуровень максимальная степень окисления серы в соединениях с более сильными окислителями (фтором, кислородом, хлором) +6.
Химически сера очень активна, но всё же встречается в природе в виде простого вещества (самородная сера).
Основной источник самородной серы – вулканический пепел и горные породы вулканического происхождения.
В большинстве случаев сера в природе встречается в виде соединений:
- пирит (железный колчедан) FeS2
- медный блеск CuS
- цинковая обманка ZnS
- гипс CaS04
- киноварь HgS
Много серы содержится в морской воде в виде английской соли MgS04 , именно она придаёт морской воде горький привкус.
Сера образует три простых вещества (аллотропные модификации):
- ромбическую
- моноклинную
- пластическую
Ромбическая сера
Наиболее устойчивая, хрупкое вещество желтого цвета.
Это именно та сера, которую мы все привыкли видеть. Сера часто встречается в домашних аптечках (применяется как пищевая добавка, а также как наружное средство при лечении кожных заболеваний), а также она используется в сельском хозяйстве для окуривания растений от паразитов и грибков.
Моноклинная сера
Менее устойчивая модификация, образуется при медленном охлаждении расплавленной серы.
Пластическая сера
Неустойчива, получить её можно, если расплавленную серу охладить резко (например, вылить в холодную воду).
Моноклинная и пластическая модификации с течением времени самопроизвольно переходят в ромбическую.
У меня есть дополнительная информация к этой части урока!
Аллотро́пия (от греческого аллос «другой» и тропос «поворот, свойство») — существование веществ одного и того же химического элемента, различных по строению и свойствам, так называемых аллотропных модификаций или форм.
Явление аллотропии обусловлено различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
История и происхождение названия
История открытия
Точное время открытия серы не установлено, но этот элемент использовался до нашей эры.
Сера использовалась жрецами в составе священных курений при религиозных обрядах. Она считалась произведением сверхчеловеческих существ из мира духов или подземных богов.
Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников.
Около VIII века китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд.
Пресвитер Теофил (XII век) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте.
В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов.
В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию.
С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы.
Происхождение названия
Слово «сера», известное в древнерусском языке с XV века, заимствовано из старославянского «сѣра» — «сера, смола», вообще «горючее вещество, жир». Этимология слова не выяснена до настоящих времен, поскольку первоначальное общеславянское название вещества утрачено и слово дошло до современного русского языка в искажённом виде.
По предположению Фасмера, «сера» восходит к лат. сera — «воск» или лат. serum — «сыворотка».
Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur), предположительно, восходит к индоевропейскому корню *swelp — «гореть».
Сера в природе
Большие скопления самородной серы (с содержанием > 25 %) редки, они встречаются в местах вулканической активности, им сопутствуют сернистые фумаролы и сернистые воды.
Серная руда разрабатывается в месторождениях самородной серы, добывается из сульфидных руд и промышленных газов.
Серные бактерии могут окислять сероводород от гниющих органических остатков до серы и накапливать её.
Природные минералы серы
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и в связанном виде.
Важнейшие природные минералы серы: FeS2 — железный колчедан, или пирит, ZnS — цинковая обманка, или сфалерит (вюрцит), PbS — свинцовый блеск, или галенит, HgS — киноварь, Sb2S3 — антимонит, Cu2S — халькозин, CuS — ковеллин, CuFeS2 — халькопирит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обусловливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Строение атома серы
В атоме серы 16 электронов (рис. 51), из них 6 электронов — на внешнем электронном слое:
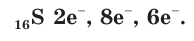
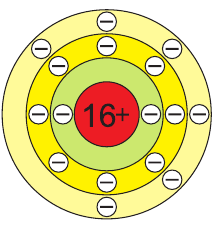

В соединениях с металлами и водородом сера обычно проявляет степень окисления, равную –2, например 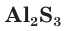
— сульфид алюминия. В соединениях с более электроотрицательными элементами (F, O, N, Cl, Br) атомы серы проявляют положительные степени окисления, чаще +4 и +6, например 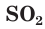
— оксид серы(IV), 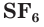
— фторид серы(VI).
Свойства
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.

Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
| Взаимодействие | Продукты реакции | Пример |
| С металлами | Сульфиды | Cu + S → CuS |
| С кислородом при 280°С | Оксид серы | – S + O2 → SO2; – 2S + 3O2 → 2SO3 |
| С водородом при нагревании | Сероводород | H2 + S → H2S |
| С фосфором при нагревании в отсутствии воздуха | Сульфид фосфора | 2P + 3S → P2S3 |
| С фтором | Фторид серы | S + 3F2 → SF6 |
| С углеродом | Сероуглерод | 2S + C → CS2 |
| С кислотами | Кислота | S + 2HNO3 → 2NO + H2SO4 |
| Со щёлочью | Сульфиды и сульфиты | 3S + 6KOH → K2SO3 + 2K2S + 3H2O |
Сера входит в состав белков. Большое количество серы накапливается в волосах.

Фазовая диаграмма серы
Элементарная кристаллическая сера может существовать в виде двух аллотропных модификаций (энантиотропия серы) — ромбической и моноклинной, — то есть сера диморфна, поэтому для элементарной серы возможно существование четырёх фаз: твёрдой ромбической, твёрдой моноклинной, жидкой и газообразной, а на фазовой диаграмме серы (см. рисунок; для давления использован логарифмический масштаб) имеются два поля твёрдых фаз: область ромбической серы и область существования моноклинной серы (треугольник АВС).
На фазовой диаграмме серы:
- DA — линия возгонки ромбической серы Sp, описывающая зависимость давления насыщенного пара серы Sп от температуры над твёрдой ромбической серой;
- AС — линия возгонки моноклинной серы Sм, описывающая зависимость давления насыщенного пара серы от температуры над твёрдой моноклинной серой;
- СF — линия испарения жидкой серы Sж, описывающая зависимость давления насыщенного пара серы от температуры над расплавом серы;
- AB — линия полиморфного превращения сера ромбическая сера моноклинная, описывающая зависимость температуры фазового перехода между ромбической и моноклинной серой от давления;
- ВЕ — линия плавления ромбической серы, описывающая зависимость температуры плавления ромбической серы от давления;
- CВ — линия плавления моноклинной серы, описывающая зависимость температуры плавления моноклинной серы от давления.
Пунктирные линии отражают возможность существования метастабильных фаз, которые наблюдаются при резком изменении температуры:
- AО — линия сублимации перегретой ромбической серы;
- ВО — линия плавления перегретой ромбической серы;
- СО — линия испарения переохлаждённой жидкой серы;
На фазовой диаграмме серы имеются три стабильные тройные точки и одна метастабильная, каждая из которых отвечает условиям термодинамического равновесия трёх фаз:
- точка А (дополнительная): равновесие твёрдой ромбической, твёрдой моноклинной и газообразной серы;
- точка В (дополнительная): равновесие твёрдой ромбической, твёрдой моноклинной и жидкой серы;
- точка С (основная): равновесие твёрдой моноклинной, расплавленной и газообразной серы;
- точка О (метастабильная): метастабильное равновесие между перегретой твёрдой ромбической, переохлаждённой жидкой и газообразной серой.
Как показывает фазовая диаграмма, ромбическая сера не может одновременно находиться в равновесии с расплавом и парами серы, поэтому в основной тройной точке (когда равновесные фазы находятся в разных агрегатных состояниях) твёрдая фаза представлена моноклинной серой. Метастабильная тройная точка появляется вследствие низкой скорости превращения одной кристаллической модификации серы в другую.
Получение и применение серы
В промышленных масштабах серу получают из природных месторождений самородной серы. Сера является сырьем для производства серной кислоты. Е1 используют в бумажной промышленности, в сельском хозяйстве, в производстве резины, красителей, пороха и т.д. Широкое применение сера нашла в медицине, например, сера входит в состав различных мазей и присыпок, применяемых при кожных заболеваниях и т.д.
Биологическая роль
Сера — один из биогенных элементов. Сера входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), ферментов. Сера участвует в образовании третичной структуры белка (формирование дисульфидных мостиков). Также сера участвует в бактериальном фотосинтезе (сера входит в состав бактериохлорофилла, а сероводород является источником водорода). Окислительно-восстановительные реакции серы — источник энергии в хемосинтезе.
В человеке содержится примерно 2 г серы на 1 кг массы тела.
Биологическое действие
Чистая сера не ядовита, но многие летучие серосодержащие соединения ядовиты (сернистый газ, серный ангидрид, сероводород и др.).
Пожароопасные свойства серы
Тонкоизмельчённая сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углём, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Средства тушения: распылённая вода, воздушно-механическая пена.
По данным В. Маршалла пыль серы относится к разряду взрывоопасных, но для взрыва необходима достаточно высокая концентрация пыли — порядка 20 г/м³ (20 000 мг/м³), такая концентрация во много раз превышает предельно допустимую концентрацию для человека в воздухе рабочей зоны — 6 мг/м³.
Пары образуют с воздухом взрывчатую смесь.
Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабо светящееся голубое пламя высотой до 5 см. Температура пламени при горении серы составляет 1820 °C.
Так как воздух по объёму состоит приблизительно из 21 % кислорода и 79 % азота и при горении серы из одного объёма кислорода получается один объём SO2, то максимальное теоретически возможное содержание SO2 в газовой смеси составляет 21 %. На практике горение происходит с некоторым избытком воздуха, и объёмное содержание SO2 в газовой смеси меньше теоретически возможного, составляя обычно 14—15 %.
Обнаружение горения серы пожарной автоматикой является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Тепловыделение при пожаре приводит к температуре ниже, чем при пожарах других распространённых пожароопасных веществ. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере. Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаружено распространёнными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля, не будут работать.
Для эффективного обнаружения пламени используется ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы.
Пожары на складах серы
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет-Уэст Западно-Капской провинции Южно-Африканской Республики, произошёл крупный пожар, погибли два человека.
16 января 2006 года около 17 часов на череповецком предприятии «Аммофос» загорелся склад с серой. Общая площадь пожара — около 250 квадратных метров. Полностью ликвидировать его удалось лишь в начале второго ночи. Жертв и пострадавших нет.
15 марта 2007 года рано утром на ООО «Балаковский завод волоконных материалов» произошёл пожар на закрытом складе серы. Площадь пожара составила 20 м2. На пожаре работало 4 пожарных расчёта с личным составом в 13 человек. Примерно через полчаса пожар был ликвидирован. Никто не пострадал.
4 и 9 марта 2008 года произошло возгорание серы в Атырауской области в хранилище серы ТШО на Тенгизском месторождении. В первом случае очаг возгорания удалось потушить быстро, во втором случае сера горела 4 часа. Масса горевших отходов нефтепереработки, к каковым по казахстанским законам отнесена сера, составила более 9 тонн.
В апреле 2008 недалеко от посёлка Кряж Самарской области загорелся склад, на котором хранилось 70 тонн серы. Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчётов и спасатели. В тот момент, когда пожарные оказались около склада, горела ещё не вся сера, а только её небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землёй и залиты водой.
В июле 2009 года в Днепродзержинске горела сера. Пожар произошёл на одном из коксохимических предприятий в Баглейском районе города. Огонь охватил более восьми тонн серы. Никто из сотрудников комбината не пострадал.
В конце июля 2012 года под Уфой в посёлке Тимашево загорелся склад с серой площадью 3200 квадратных метров. На место выехало 13 единиц техники, в тушении пожара задействован 31 пожарный. Произошло загрязнение атмосферного воздуха продуктами горения. Погибших и пострадавших нет.
Примеры решения задач
ПРИМЕР 1
| Задание | Какое количество вещества атомарной серы содержится в сульфиде железа (II) массой 22 г. |
| Решение | Молярная масса сульфида железа (II), рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 88 г/моль. Тогда, количество вещества сульфида железа (II) будет равно: n(FeS) = m(FeS) / M(FeS); n(FeS) = 22 / 88 = 0,25 моль. Т.к. в состав молекулы сульфида железа (II) входит один атом серы, то количество вещества атомарной серы будет также равно 0,25 моль. |
| Ответ | Количество вещества атомарной серы — 0,25 моль. |
ПРИМЕР 2
| Задание | При взаимодействии серы с концентрированной азотной кислотой (ω = 60%, ρ = 1,27 г/мл) образовалась серная кислота и выделился оксид азота (II), объемом 67,2 л. Какая масса серы и какой объем раствора азотной кислоты потребовались для этого? |
| Решение | Запишем уравнение реакции: S + 2HNO3 = 2NO + H2SO4. Рассчитаем количество вещества оксида азота (II): n(NO) = V(NO) / Vm ; n(NO) = 67,2 / 22,4 = 3 моль. Согласно уравнению n(NO):n(S) = 2:1, следовательно n(S) = 1/2×n(NO) = 1,5 моль. Молярная масса серы, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 32 г/моль. Тогда масса серы, вступившей в реакцию будет равна: m(S) = n(S) × M(S) = 1,5 × 32 = 48 г. Согласно уравнению n(NO):n(HNO3) = 2:2, следовательно n(HNO3) = n(NO) = 3 моль. Молярная масса азотной кислоты, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 63 г/моль. Тогда масса азотной кислоты, вступившей в реакцию будет равна: m(HNO3) = n(HNO3) × M(HNO3) = 3 × 63 = 189 г. Масса раствора азотной кислоты: m(HNO3)solution = m(HNO3) / ω = 189 / 0,6 = 315 г. Тогда объем раствора азотной кислоты, вступившей в реакцию: V(HNO3) = m(HNO3)solution / ρ = 315 / 1,27 = 229,9 мл. |
| Ответ | Масса серы – 48 г; объем раствора азотной кислоты — 229,9 мл. |